帕金森病 (PD) 是一种神经退行性疾病,其特征之一是脑内调节运动功能的细胞逐渐退化。据估计,该病的发病率在过去 25 年中翻了一番,最近的数据表明,目前有超过 850 万人患有帕金森病。患有 PD 的人会表现出运动和非运动症状。主要运动症状包括失语、动作迟缓(运动迟缓)和正常步行模式的改变。
经过多年的研究,人们已经确定,这些运动症状背后的驱动力是由错误折叠的 α 突触核蛋白在不可溶路易体中积累而引发的。这一过程导致神经元细胞功能紊乱,并导致多巴胺的缺乏。由于多巴胺是调节运动的关键神经递质,多巴胺能神经元的逐渐丧失导致帕金森病患者出现毁灭性的运动症状。α 突触核蛋白聚集体的细胞间传递对于不同脑区神经元和星形胶质细胞之间疾病病理的传播至关重要。
参与内吞作用的跨膜蛋白——脂蛋白受体相关蛋白 1 (LRP1)——在病理病理学中,病理性 α 突触核蛋白在大脑不同区域的扩散中起着关键作用。动物 PD 模型提供了令人信服的证据,表明 LRP1 受体通过介导 α 突触核蛋白内化来调节黑质纹状体系统区域之间的细胞传递——这对于控制运动至关重要。对 LRP1 在 α 突触核蛋白内化和传递中的调节作用的这项发现对于开发 α-突触核蛋白相关神经退行性疾病的新疗法至关重要。
LRP1 和神经退行性疾病
在这项研究开始之前,已经有发表的科学文献证实了内吞受体 LRP1 与各种神经退行性疾病之间的联系。据研究发现,帕金森病患者的 LRP1 蛋白水平有所升高,并且LRP1 已被证明对tau蛋白 - 一种其错误折叠会导致阿尔茨海默病发病的蛋白质-有调节作用。LRP1 衔接蛋白是多因素晚期阿尔茨海默病的最强遗传风险因素,这一发现进一步证实了 LRP1 与神经退行性疾病之间的关系。研究人员发现,目前缺乏有关 LRP1 的确切作用以及其影响 α-突触核蛋白摄取和传播的机制的信息。因此,作者开始使用帕金森病模型来评估 LRP1 在 α-突触核蛋白病理学中的确切作用。
重现帕金森病病理
α 突触核蛋白单体错误折叠并聚集成寡聚体可以直接造成神经退行,这些寡聚结构会在脑内迅速聚积成不溶性前体原纤维 (PFF)。为了在体内重现帕金森病的病理特征,将StressMarq 的α 突触核蛋白前体原纤维 (产品目录号#SPR-322 )注射到食蟹猕猴和 C57BL/6 小鼠的大脑纹状体区域,从而诱导动物模型。注射后成功观察到了运动迟缓等帕金森病症状,并伴随着纹状体区域多巴胺能神经元的大量缺失。有趣的是,多巴胺能神经元的缺失也出现在黑质 (SN) 区域,这表明疾病病理从大脑的一个区域传递到另一个区域。
接下来,需要确定帕金森病患者中观察到的 LRP1 水平升高是否也出现在动物模型中。事实上,小鼠和猴子模型的 STR 和 SN 脑区均明显存在 LRP1 蛋白的增加。数据最终表明,由 α 突触核蛋白原纤维引起的 α 突触核蛋白病理可以从 STR 运输到 SN 区域,而 LRP1 负责介导这一过程。这两个区域都是黑质纹状体系统的重要组成部分,其中 STR 处理多巴胺能输入以调节运动控制,而 SN 产生多巴胺。
下调LRP1的保护作用
尽管有关纤维状 α 突触核蛋白的致病功能已经有研究证实,但疾病发生和发展背后的分子机制仍不清楚。解密 α 突触核蛋白和 LRP1 之间相互作用的性质是理解 α 突触核蛋白调节的关键。为了进一步探究 α 突触核蛋白和 LRP1 之间的关系,研究者采用了 PC12 神经元细胞模型。将 PC12 细胞与不同浓度的 StressMarq α 突触核蛋白前体原纤维(1 型)(产品目录号#SPR-322 )一起孵育后,评估细胞的存活率。用α 突触核蛋白聚集体处理会产生神经毒性作用,并且造成细胞存活率呈剂量依赖性降低。
随后对细胞裂解物进行蛋白质印迹分析,结果显示 α-突触核蛋白和 LPR1 水平增加。最后,通过免疫荧光和共聚焦显微镜观察神经元细胞,证实外源性纤维状 α-突触核蛋白的吸收,并量化得出 LRP1 信号强度增加 220%。然而,在 PC12 模型中添加StressMarq 的α-突触核蛋白单体(1 型)(产品目录号#SPR-321 )后,并没有引起 LPR1 信号同样显著的增加。
在研究的最后阶段,研究人员假设调节 LPR1 蛋白水平是否也能调节 α-突触核蛋白的病理性积累。事实上,LRP1 基因的敲除有效抑制了黑质纹状体系统中 α-突触核蛋白的增加,成功挽救了神经退行性病变。此外,阻断 α-突触核蛋白 PFF 的赖氨酸残基可降低神经元细胞中伴随蛋白质的增加。这表明 LRP1 通过与α-突触核蛋白 N 端的赖氨酸相互作用来调节摄取和传输。
调节 α 突触核蛋白的传输
在这项研究中,研究人员发现了 LRP1 内吞受体对致病性 α 突触核蛋白在整个黑质纹状体系统区域的传播中的作用。使用 StressMarq 的 α 突触核蛋白前体原纤维(1 型)(目录号 #SPR-322)和单体(目录号 #SPR-321)在体内和体外诱导帕金森病病理学,使研究人员能够研究 α 突触核蛋白是怎样被调节内化然后传输到大脑的不同区域的。
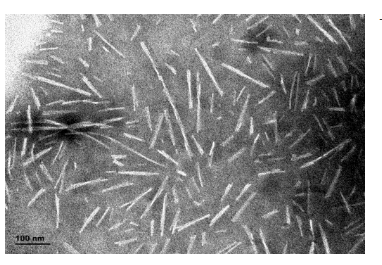
[图片来自StressMarq网站。] StressMarq 的 Alpha 突触核蛋白前体原纤维 (PFF)(产品目录号:SPR-322 )的透射电子显微镜 (TEM) 图像
概括
突触核蛋白向不同大脑区域的传输直接导致毒性聚集体的扩散和神经退化,这与帕金森病的运动和认知症状恶化有关。尽管已证实突触核蛋白和内吞受体 LRP1 之间存在紧密联系,但这种关系背后的分子机制仍然未知。罗教授等人的最新研究揭示了 LRP1 在帕金森病中对突触核蛋白吸收和传播的调节作用。这两种蛋白质在PD疾病模型中均有升高,通过掩盖突触核蛋白纤维聚集体中N 端赖氨酸残基可以逆转病理性积累。这项研究的发现标志着在制定预防帕金森病的策略和推动更广泛的神经退行性疾病研究领域方面迈出了重要一步。
相关StressMarq产品
StressMarq 的多种α-突触核蛋白结构能够重现神经退行性疾病中的 α-突触核蛋白病理。StressMarq 的人源 α-突触核蛋白 N 端乙酰化前体原纤维 (SPR-332)(产品目录号 SPR-332 ),它通过增强蛋白质稳定性、减少聚集和影响相互作用发挥保护作用。人类重组 N 端乙酰化 α-突触核蛋白单体(1 型)(产品目录号 SPR-331 )也可用于研究这种结构修饰对生理形式的影响。访问我们的网站了解更多信息,包括使用我们的专用蛋白质进行神经退行性疾病研究的最新科学出版物。
参考文献
1. Low-density lipoprotein receptor-related protein 1 mediates α-synuclein transmission from the striatum to the substantia nigra in animal models of Parkinson's disease. Luo, H, et al. Neural Regeneration Research. 2024.
更多详情请咨询Stressmarq全国授权一级代理 - 欣博盛生物
全国服务热线: 4006-800-892 邮箱: market@neobioscience.com
深圳: 0755-26755892 北京: 010-88594029
上海: 021-34613729 广州:020-87615159
代理品牌网站: www.neobioscience.com
自主品牌网站: www.neobioscience.net
