上海交通大学附属第一人民医院张箴波团队以题为“Metformin sensitizes endometrial cancer cells to chemotherapy through IDH1-induced Nrf2 expression via an epigenetic mechanism”发表于Nature子刊《Oncogene》(影响因子:6.854)。该研究,首次揭示了“神药”二甲双胍抑制子宫内膜癌的新机制,指出了DNA羟甲基化修饰在此过程中起的关键作用。
研究背景:
二甲双胍,因其降糖能力强,副作用小,是糖尿病患者主要的控糖药物。随着研究的深入,二甲双胍其他的生物学功能也逐渐被发现,相关研究在Nature、Cell、Cell Stem Cell等期刊上频频亮相,主要包括:抑癌、降血脂、降血压、改善脂肪肝、改善多卵巢综合症、减脂、延长寿命和预防老年痴呆症等等等等!!所以,被人们冠以“神药”的称号。

DNA羟甲基化被称为哺乳动物DNA中的“第六碱基”,与癌症、神经退行性疾病等人类重大疾病密切相关,是表观遗传学领域的新热点。本篇文章的作者在子宫内膜癌细胞中检测到DNA羟甲基化修饰(本文DNA羟甲基化相关服务,由云序生物提供),并证实这种修饰可促进癌细胞的增殖。随后,作者用“神药”及其他抗癌药物处理增殖的癌细胞后发现增殖过程被抑制。
那作者具体是怎么做的?让我们详细看看。
研究样本:
人类细胞系:子宫内膜癌细胞系(Ishikawa,HEC-1A,SPEC2,HEC-1B,AN3CA,ECC-1)、正常子宫内膜细胞系。
人类组织:子宫内膜癌组织200例(未分期样本160例;分期样本40例:G1期25例,G2期8例,G3期7例)、增生期子宫内膜组织10例。
研究结果:
1.IDH1在子宫内膜癌组织及癌变细胞系中高表达
作者通过免疫组化,发现IDH1基因在癌变的子宫内膜中的阳性染色率显著高于增生期子宫内膜组织(图1A,B)。为保证结果准确,作者将样本扩大至每组35人,应用ELISA法检测血浆中IDH1的表达量,同样证实癌变患者血清中IDH1高表达(图1C)。
那么,IDH1基因在细胞中的表达情况是怎样的呢?通过检测8种子宫内膜癌细胞系(图1D),在mRNA和蛋白水平上,检测到IDH1基因在Ishikawa,Spec2,HEC-1A和HEC-1B细胞系中高表达。综上,IDH1在子宫内膜癌组织和癌变细胞系中高表达。
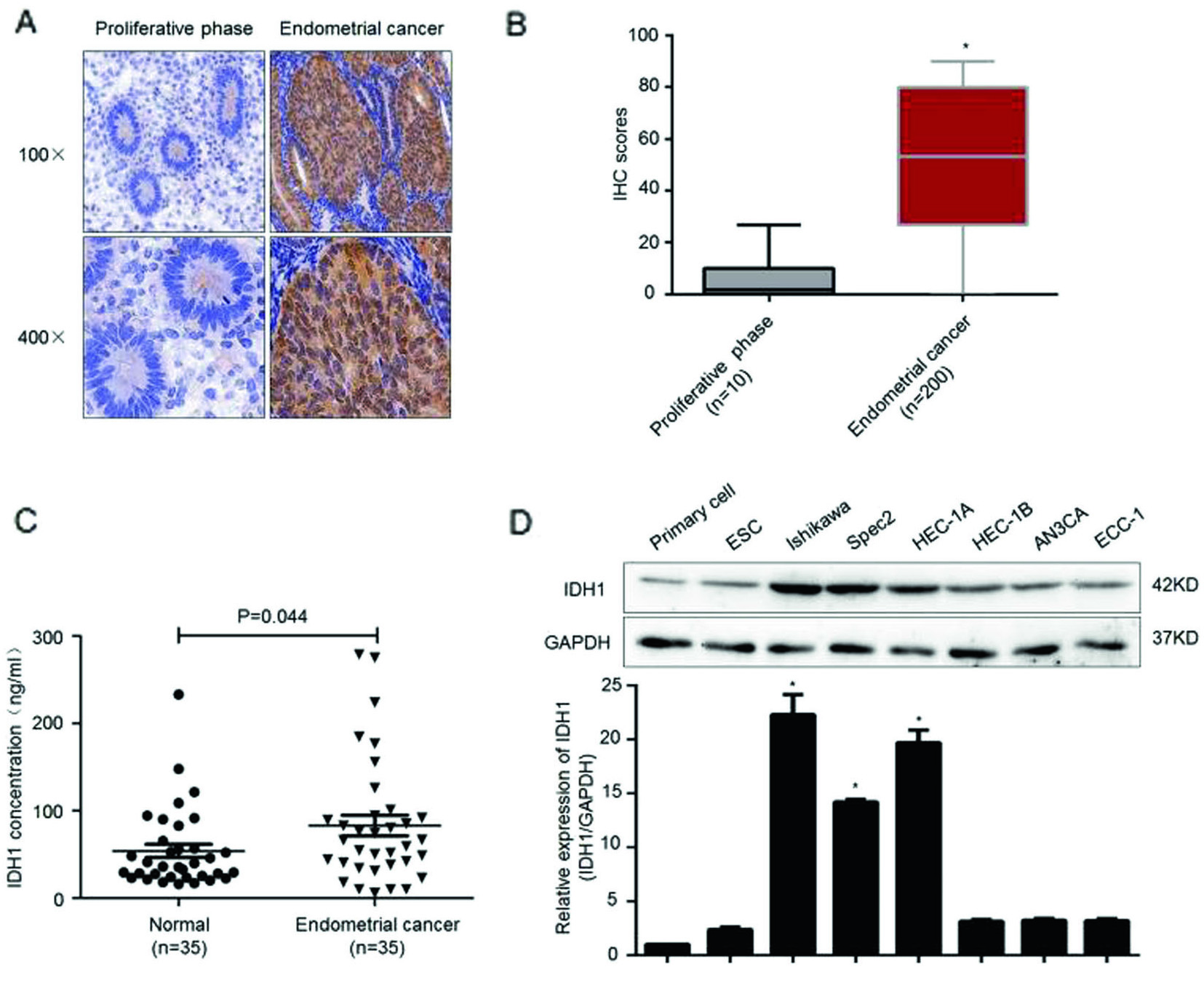
图1. IDH1在组织和细胞系中的表达情况
2.二甲双胍通过抑制IDH1表达提高子宫内膜癌细胞对化疗的敏感性
作者以IDH1基因表达top 3的细胞系为材料,检测不同二甲双胍用量和反应时间内IDH1的表达量,结果证实二甲双胍可抑制IDH1表达(图2A,B)。另外,细胞增殖和计数实验证实二甲双胍与抗癌药物可协同抑制癌细胞增殖(图2C,D)。可IDH1是否参与上述癌细胞增殖过程呢?作者通过体外干扰实验,成功抑制IDH1基因表达(图2E),并检测到干扰细胞在分别处理两种抗癌药物后的增殖能力比对照组低(图2F)。
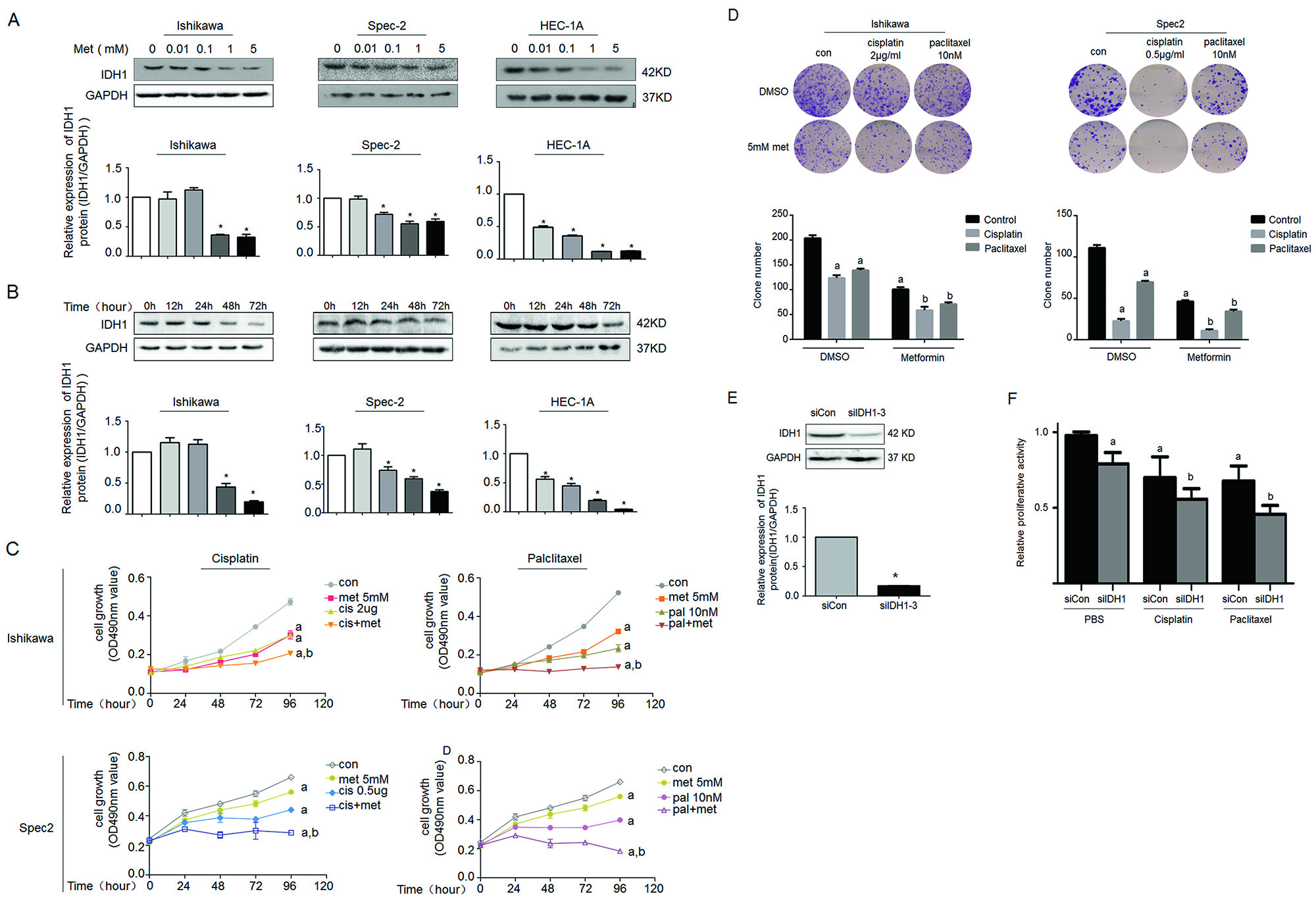
图2.二甲双胍抑制IDH1表达并提高癌细胞对化疗的敏感度
3.ɑ-KG提高二甲双胍对化疗的敏感度
ɑ-KG是IDH1酶的产物之一,在本研究中,作者用二甲双胍处理子宫内膜癌细胞,发现ɑ-KG的表达与二甲双胍的反应时间和剂量成反比(图3 A,B)。ɑ-KG在过表达IDH1基因的细胞系中高表达,而二甲双胍处理后,ɑ-KG表达量受抑制,说明二甲双胍通过抑制IDH1基因表达,从而抑制ɑ-KG表达(图3C)。并与抗癌药共用后,能有效抑制细胞增殖(图3D)。
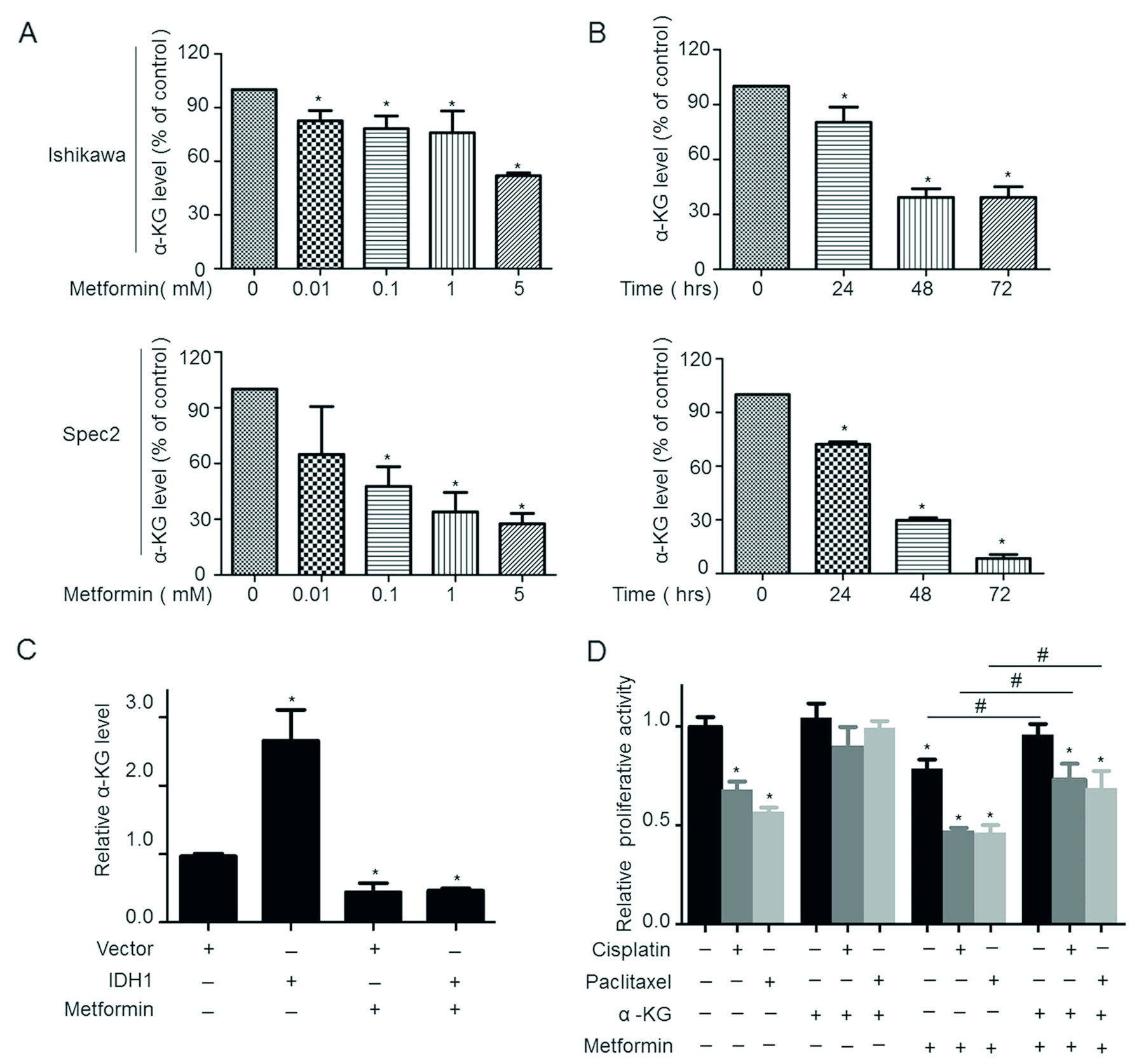
图3. α-KG参与二甲双胍调控化疗敏感性
4.二甲双胍通过TET1羟甲基化调控IDH1-α-KG信号通路促进抗癌药的药效
TET1作为一种依赖α-KG的加氧酶,能够促进5-甲基化胞嘧啶转为5-羟甲基胞嘧啶,IDH1作为α-KG的前体,与TET结合的功能研究还不清楚。所以,作者过表达IDH1后,检测到TET1的mRNA与蛋白含量上调(图4A,B),且α-KG表达量也上升了(图4C)。通过免疫荧光实验,观测到IDH1或TET1基因可提高细胞内羟甲基化水平,而二甲双胍处理或敲低处理后,羟甲基化水平受抑制(图4D),并且TET1与二甲双胍的剂量和反应时间一致(图4E)。Dot blot实验(图4F)再次证实IDH1过表达细胞羟甲基化水平可被二甲双胍抑制。并通过细胞增殖实验,检测过表达TET1后,癌细胞增殖量略有提高,但化疗药物对细胞增殖影响不大(图4G)。
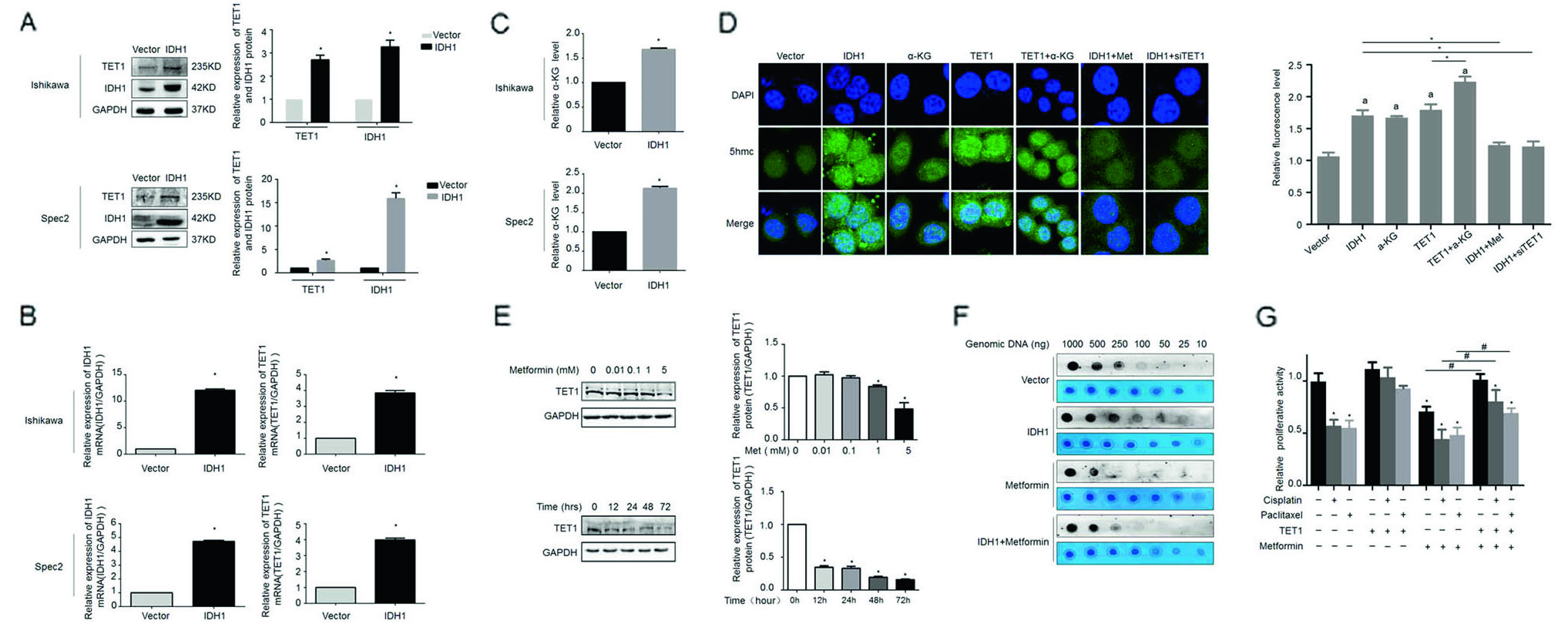
图4. TET1参与二甲双胍促进子宫内膜癌细胞的敏感性
5. Nrf2羟甲基化水平的降低影响二甲双胍引起的化疗敏感性
Nrf2与IDH1在子宫内膜癌组织的分布和发病时期一致(图5A,B),且Nrf2可与TET1结合(图5C)。已知TET1影响羟甲基化水平(图4D),那Nrf2能否影响羟甲基化水平呢?作者通过Dot blot实验,证实Nrf2基因的羟甲基化离不开TET基因调控(图5D)。二甲双胍处理细胞中Nrf2、TET1等基因在蛋白水平的表达下降(图5E),且Nrf2启动子区域上羟甲基化水平下降了(图5F,G),说明Nrf2发生羟甲基化的作用区域可能在启动子上。过表达keap1基因(与Nrf2基因作用相反)后,细胞增殖活性高于对照组(图5H),说明Nrf2基因对细胞增殖起抑制作用。综上,二甲双胍通过影响TET1基因,降低Nrf2启动子区DNA羟甲基化修饰,从而提高对化疗药物的敏感度。
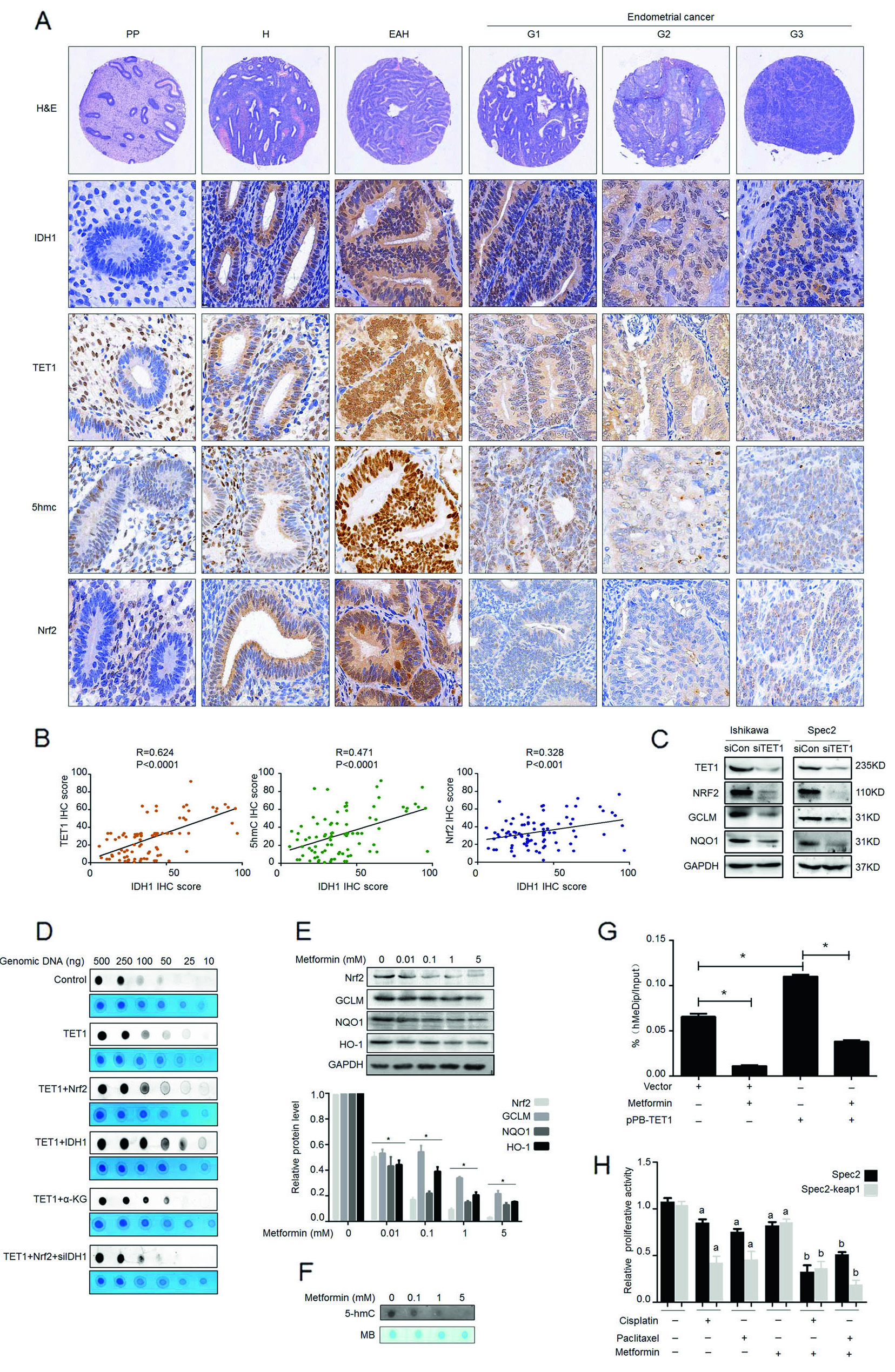
图5.二甲双胍通过降低Nrf2的羟甲基化调控癌细胞对化疗药物的敏感性
6. Nrf2基因通过正向反馈加强IDH1信号通路
上文可知,二甲双胍能够抑制Nrf2和相关基因的表达。因此,作者想看看影响Nrf2基因表达后,相关基因的变化趋势,结果发现两者表达趋势是一致的(图6A-D)。且抑制Nrf2基因后,促进了ɑ-KG表达(图6E,F),即Nrf2基因调控了IDH1-ɑ-KG-TET1-Nrf2信号通路。随后,作者对IDH1启动子区序列进行结构预测,发现该区域与NF2结合位点有6个抗氧化反应元件(ARE)(图6G),并发现其中一个报告基因与Nrf2结合显著。以上结果表明,Nrf2通过影响IDH1转录,调控IDH1-ɑ-KG-TET1-Nrf2信号通路。
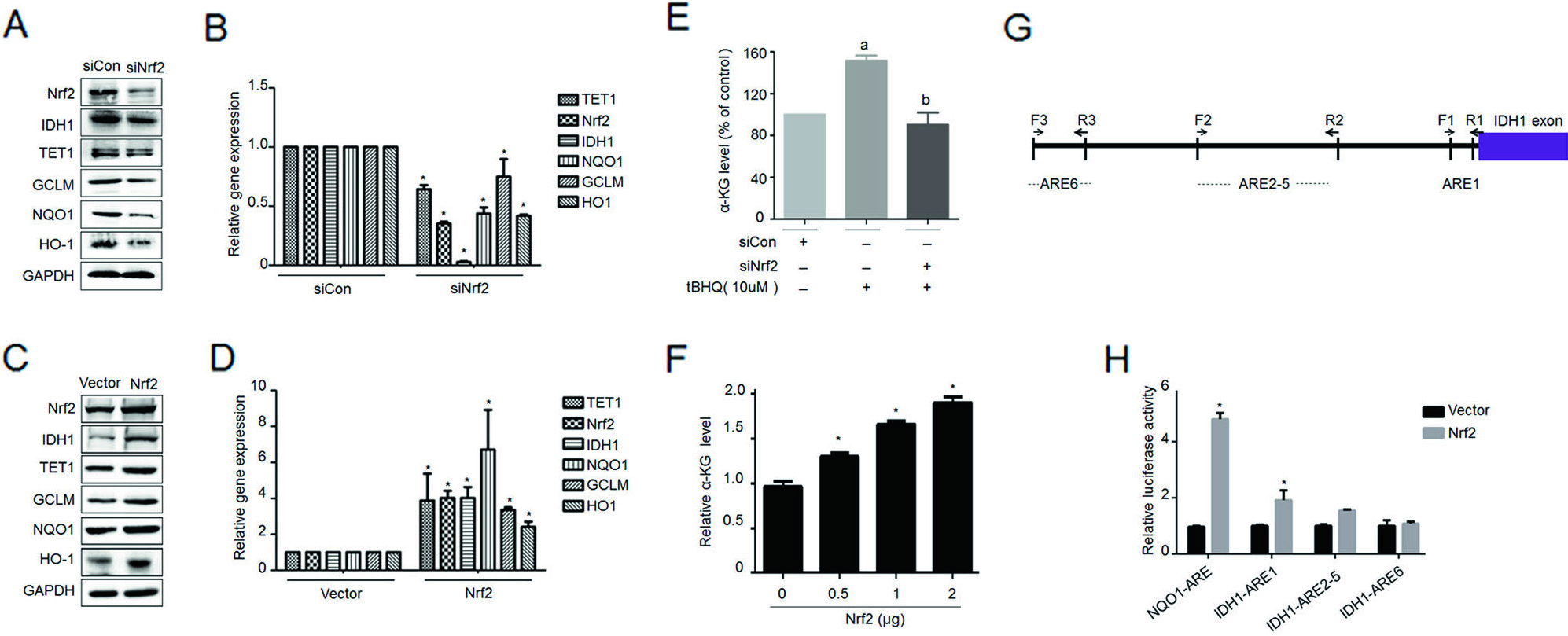
图6. Nrf2基因通过正向反馈加强IDH1信号通路
小结:
这篇文章干货满满,不但揭示了二甲双胍参与IDH1-ɑ-KG-TET1-Nrf2通路,从而抑制子宫内膜癌发展,还证实了TET1与Nrf2共同影响DNA羟甲基化水平,为今后研究子宫内膜癌对化疗药物的耐药性提供理论依据。
全文信息:
Bai M, Yang L, Liao H, et al. Metformin sensitizes endometrial cancer cells to chemotherapy through IDH1-induced Nrf2 expression via an epigenetic mechanism. Oncogene(2018).
特别推荐产品:
云序生物将羟甲基化DNA免疫共沉淀技术和高通量测序完美结合,提供全面的DNA羟甲基化测序服务,帮助客户快速获取全基因组范围内DNA羟甲基化谱和不同样品中羟甲基化分布的差异表达谱。配合强大的生信分析实力,为您提供海量的测序数据和出版级分析图片。
云序相关产品推荐:
上海云序生物科技有限公司
Shanghai Cloud-seq Biotech Co., Ltd.
地址:上海市松江区莘砖公路518号20号楼3楼
电话:021-64878766
传真:021-64878766
网址:www.cloud-seq.com.cn
邮箱:market@cloud-seq.com.cn
