m6A是RNA的一种表观遗传修饰,将这种化学标记添加到RNA分子中,通过影响RNA分子的命运来调节基因表达。这种转录后RNA修饰是可逆的,由甲基转移酶“writers”和去甲基化酶“erasers”调节。m6A修饰的RNA的命运取决于识别和结合它们的不同“readers”的功能。由于m6A甲基化修饰在调节癌症进展中的重要作用,近年来对其的研究有所增加。
非编码RNAs(ncRNAs)是一类从基因组转录而来的RNA分子,但由于其缺乏明确的翻译成蛋白质或肽的潜力,其作用一直被忽视。然而,对ncRNAs的这种误解现在已经完全被推翻了!ncRNAs调节多种疾病,特别是肿瘤,并且已经证实它们几乎在所有类型的肿瘤中都能发挥促瘤或抑瘤作用。
那目前我们有发现m6A修饰的ncRNAs在哪些类型肿瘤中发挥作用呢?具体的调控机制又是怎样的呢?有什么潜在的临床治疗意义吗?
接下来,云序生物通过解析下面这篇高分综述,帮您一起总结m6A修饰非编码RNAs在各类肿瘤中的调控机制及作用!
在2023年3月份,在Nature子刊上发表了题为“The roles of N6-methyladenosine and its target regulatory noncoding RNAs in tumors: classification, mechanisms, and potential therapeutic implications”的综述,这篇综述讨论了m6A修饰的不同类型ncRNAs,并总结了其调控机制。最后讨论了m6A修饰ncRNAs在临床治疗上的研究进展,以及m6A修饰ncRNAs在肿瘤临床治疗中的重要意义。

发表期刊:Experimental & Molecular Medicine
影响因子:13
发表时间:2022年3月1日
背景介绍
m6A修饰
N6 -甲基腺苷(m6A)是指RNA分子中腺嘌呤的第6个N原子发生甲基化(图1),这种修饰发生在终止密码子附近、5 '和3 ' -UTR区、长内部外显子和共享序列RRACH ( (R = G/A和H = A/C/ U)中。在迄今为止发现的众多RNA修饰方法中,m6A甲基化是RNA最常见和最丰富的表观遗传修饰。m6A于20世纪70年代首次在mRNA中被发现,此后被发现广泛存在于各种生物体中,如病毒、酵母和植物。
Writers:RNA的m6A修饰由“writers”完成,包括甲基转移酶(METTL3和METTL14)、Wilms肿瘤1相关蛋白(WTAP)、KIAA1429、锌指CCCH结构域蛋白13 (ZC3H13)和RNA结合基序蛋白15 (RBM15)。METTL3是该复合物的核心,负责催化RNA中腺嘌呤(A)的第6个原子的甲基化;METTL14作为RNA结合支架,激活并增强METTL37的催化活性;WTAP无催化活性,但通过招募METTL3和METTL148促进m6A甲基化;RBM15结合METTL3和WTAP,将它们招募到特定的RNA位点,促进m6A修饰;ZC3H13与WTAP结合,使其保留在核斑点(NSs)中,促进m6A修饰;KIAA1429通过招募m6A甲基转移酶复合物(MTC)到3 ' UTR和终止密码子来引导选择区域性甲基化。此外,甲基转移酶METTL15和METTL16不属于MTC,独立催化m6A甲基化。METTL16是后来发现的一种甲基化酶,可促进U6-snRNA的m6A修饰并参与RNA预剪。
Erasers:m6A的去修饰是由人类AlkB同源物H5 (ALKBH5)和α-酮戊二酸依赖双加氧酶家族的脂肪质量和肥胖(FTO)催化的,它们被称为“erasers”;因此,这种m6A修饰是可逆的(图1)。FTO通过m6A氧化成N6 -羟甲基腺苷和N6甲酰基腺苷,然后水解成腺嘌呤来催化去甲基化;相反,ALKBH5直接去除了m6A修饰。
Readers:m6A“readers”可分为以下几类:I类readers包括具有YTH结构域的,包括YTHDC1/2和YTHDF1/2/3,它们通过YTH结构域识别并结合含有m6A的转录本。II类readers是异质核糖核酸蛋白(hnRNPs),包括hnRNP C和hnRNP A2B1,它们调节转录的选择性剪接或加工。IGF2BP家族蛋白IGF2BP1/ 2/3是III类读取器,它们共享6个RNA结合结构域,包括2个RNA识别基序和4个KH结构域。其他readers包括促进ncRNA翻译的真核起始因子3 (EIF3)和影响转录本稳定性的人抗原(HuR)(图1)。
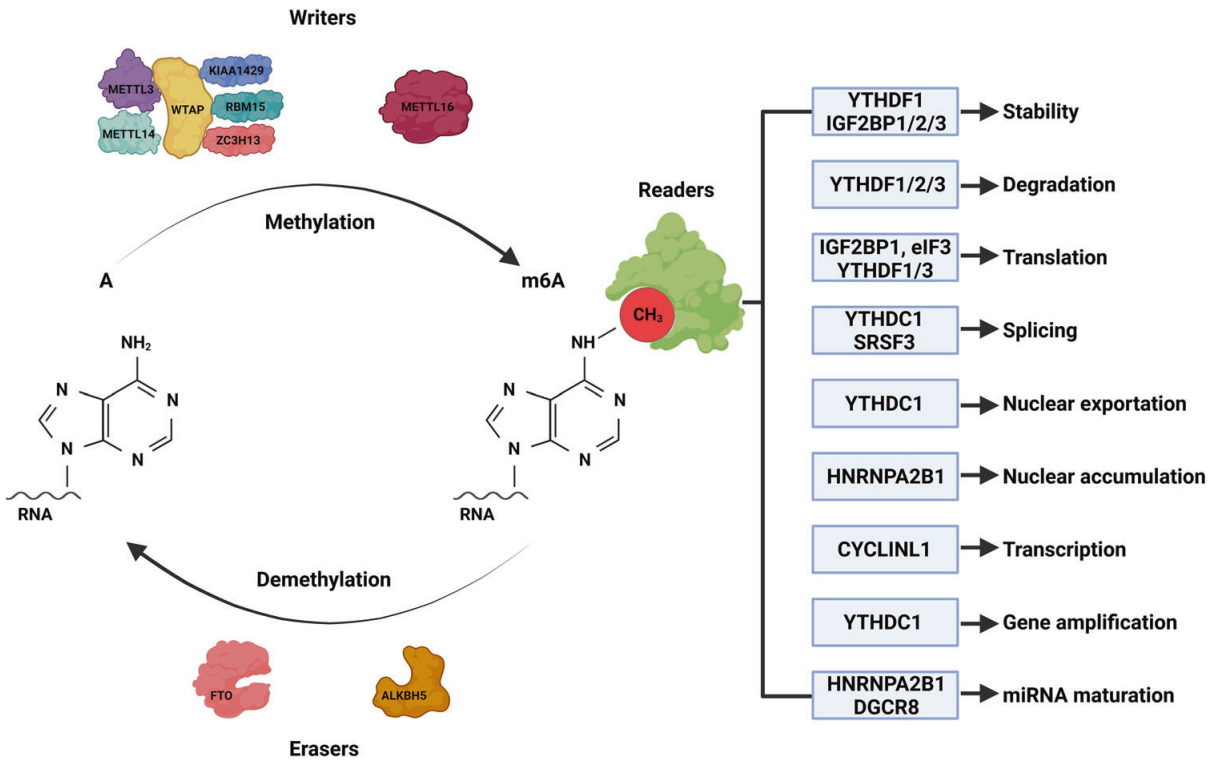
图1:m6A修饰的结构和可逆性以及m6A通过readers蛋白识别的功能
如前所述,m6A修饰是通过修饰mRNA中的多个步骤来调控基因表达的重要途径。有证据表明m6A调控pre-mRNA的剪接。含有m6A的mRNA被YTHDC1识别并在剪接后输出到细胞质中。在细胞质中,m6A修饰mRNA影响mRNA的稳定性。此外,m6A调控mRNA翻译,包括翻译起始和翻译延伸。在这里,我们将回顾肿瘤中受这三类效应物调控并因此影响肿瘤进展的ncRNA。随着测序技术的快速发展,我们发现m6A修饰通过多种方式调控ncRNA的命运。m6A修饰的RNA通过控制基因表达来调控许多病理和生理过程。m6A修饰紊乱与肿瘤的发生发展密切相关。此外,本文还简要的介绍了N1-甲基腺苷(m1A)、5-甲基胞苷(m5C)、N(7)-甲基鸟苷(m7G)、N4 -乙酰胞苷(ac4C)等RNA修饰方法。非编码RNA
ncRNA是从基因组转录而来的RNA,曾经被认为是无意义的转录副产物,因为它们没有被翻译成蛋白质。然而,随着研究的深入,人们发现这些“垃圾RNA”广泛参与重要的生物学功能。ncRNA包括许多物种,其中许多已被确定为转录后调控的标记。在这里,我们主要描述了三种最常被m6A修饰的ncRNA,即microRNA (miRNAs)、long noncoding RNA (LncRNAs)和circular RNA (circRNAs)。
miRNA:miRNA是一类长度约为20-40个核苷酸的ncRNA。miRNA基因的初级转录产物,即pri-miRNA,在细胞核内通过RNase III Drosha切割成前体miRNA,然后转运到细胞质中,在细胞质中通过RNase III Dicer进一步切割成熟。成熟的miRNA靶向mRNA的3 '非翻译区来调节基因表达。
LncRNA:lncRNA是长度至少为200个核苷酸的ncRNA。lncRNA种类繁多,它们不仅作为遗传信息的中间载体起辅助作用,而且还具有多种调控功能,如基因组印迹、染色质修饰、转录激活、转录干扰等。虽然近年来对lncRNA进行了大量的研究,但我们对其了解有限,大多数lncRNA的功能仍然未知;因此,我们有兴趣继续研究这些分子。
CircRNAs:circRNA在人类细胞中广泛表达,pre-mRNA通过反向剪接形成这种独特的ncRNA。它们没有5 '端帽子和3 '端 poly(A)尾巴,以圆形共价封闭结构存在。CircRNAs具有重要的调控功能,例如作为竞争性内源性RNA (ceRNAs)。
具有调控功能的ncRNAs的m6A甲基化修饰是表观遗传调控的重要组成部分。m6A修饰通过改变ncRNA的结构、生物发生和功能影响病理生理过程的各个方面,对许多疾病特别是癌症的发生和发展至关重要。这一研究热点已在之前的文章中进行了综述。近年来,许多相关研究阐明了新的机制,提供了新的思路。本文综述了相关机制,并讨论了靶向m6a修饰的ncRNA在癌症治疗中的重要性。
癌症中m6A writers的调节异常
如上所述,主要介导m6A修饰的MTC由几种蛋白质组成。此外,一些蛋白质(如METTL16)独立于复合物起作用,然后reader识别并结合m6A位点的ncRNA。图2a显示,ncRNA在肿瘤中被失调的writers修饰,并且readers与这些ncRNA结合。
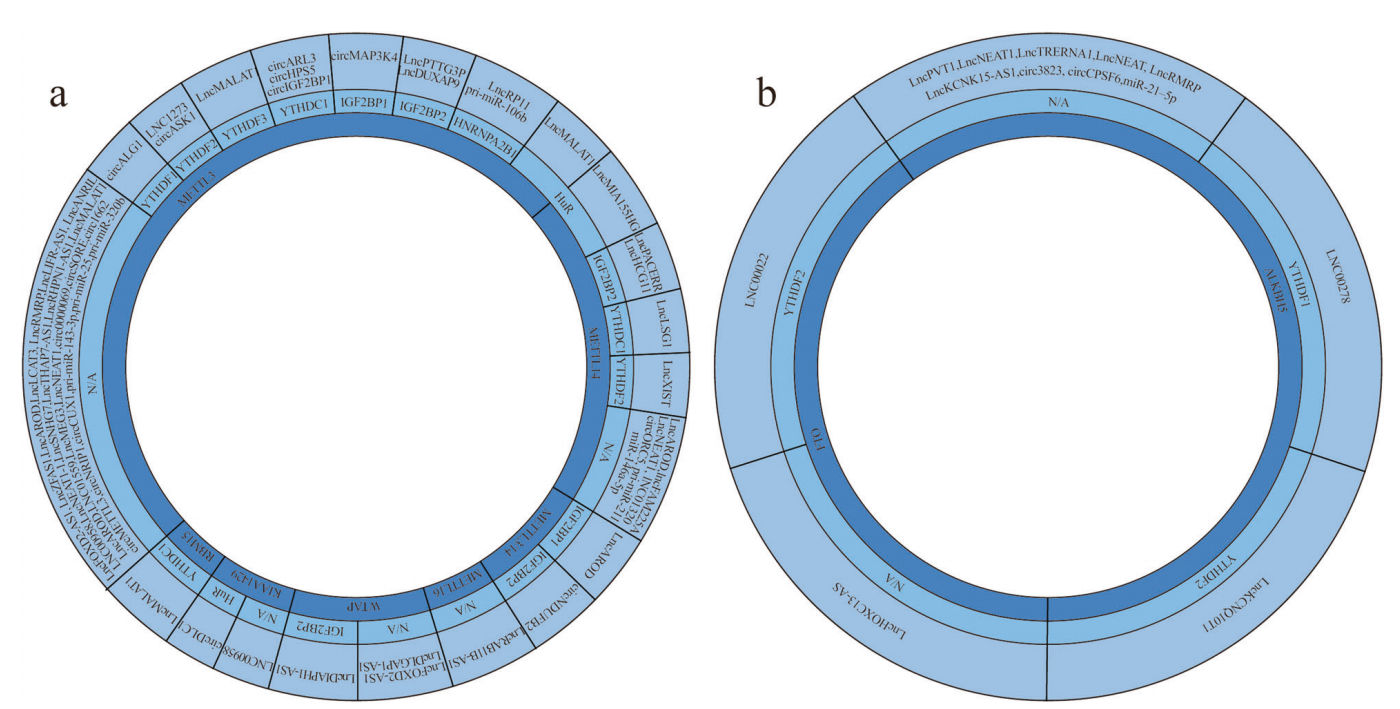
图2:ncRNAs在不同的癌症中由writers、erasers和readers调节
ETTL3
METTL3是一种S -腺苷蛋氨酸(SAM)结合蛋白。它的N端延伸包括一个前导螺旋和一个核定位信号区,后是一个锌指结构域(ZFD),一个部分有序连接子和一个C端MTase结构域(MTD)。在这些结构域中,MTD与其和METTL14的N端延伸形成最小且最稳定的复合物,可以结合辅因子底物SAM或产生SAH。ong noncoding RNA
METTL3催化lncRNA的甲基化,并通过减少RNA降解和稳定RNA转录来提高lncRNA的表达水平。m6A修饰增加了LncRMRP的稳定性,通过增强TGFBR1转录激活SMAD2/SMAD3通路,最终加速非小细胞肺癌(NSCLC)的进展。相反,在m6A甲基化修饰后,一些lncRNA由于稳定性降低而下调。由于METTL3导的m6A修饰,LncMEG3表达下调,其对miR-544b的抑制作用减弱,BTG2表达降低促进肝细胞癌(HCC)的进展。
m6A修饰的lncRNAs隔离miRNA,引起内源性竞争。通过METTL3催化,LncZFAS1的表达水平保持不变,而m6A的表达水平升高。LncZFAS1以依赖m6A的方式分离miR-647,从而发挥整体的促癌作用。m6A修饰的lncRNA的另一个重要功能是作为支架与其他分子结合。NEAT1-1通过在m6A位点与CYCLINL1结合,成为连接CYCLINL1和CDK19的桥梁,然后磷酸化RUNX2启动子中的pol II Ser2,最终促进前列腺癌(PC)骨转移。此外,m6A修饰增加了lncRNA的核积累。mettl3介导的m6A修饰导致LncRP11的核积累增加,然后LncRP11通过形成RP11-hnRNP A2B1-mRNA复合物降低Siah1和Fbxo45的水平,增加Zeb1的稳定性,最终在结直肠癌(CRC)中发挥致癌作用。
最近的一项研究也发现METTL3催化m6A修饰促进lncRNA剪接。在胰腺癌(PAC)中,m6A修饰的LncANRIL在SRSF3的参与下进行剪接。剪接体ANRIL-208增加并与RING1b和EZH2络合,通过增强DNA HR修复介导吉西他滨耐药。
Circular RNA
环状RNA是一种ncRNA,通常缺乏被翻译成蛋白质或肽的潜力。然而,经过m6A修饰后,它们可以被翻译。m6A甲基化的circMAP3K4在METTL3的催化下,可以在IGF2BP1的帮助下翻译成circMAP3K4-455aa。该蛋白与AIF相互作用,保护其免受切割并减少其核分布,最终导致HCC细胞中的顺铂耐药。
METTL3主要通过减少RNA降解和稳定RNA转录来催化circRNA甲基化并增加其表达。METTL3介导的m6A修饰导致circSORE上调,从而隔离miR-103a-2-5p和miR-660-3p。Wnt/β-catenin通路被激活,HCC对sorafenib产生耐药性。相反,一些m6A修饰的环状RNA会经历由解读器介导的核糖核酸内裂解,导致稳定性降低。ASK1-272a蛋白。circASK1编码的A竞争性结合Akt1,激活ASK1/JNK/p38信号通路,诱导肺腺癌(LUAD)细胞凋亡和化学敏感性。
m6A修饰促进环状RNA反向剪接和生物合成。METTL3过表达介导circARL3的m6A修饰,促进其生物合成。circARL3作为ceRNA吸收抑制靶癌基因的分子miR-1305,从而促进HBV +肝癌细胞的生长。METTL3介导的m6A修饰促进了circRNA核输出。METTL3介导的m6A修饰导致circHPS5的表达和细胞质转运增强,其吸收miR-370的能力增强,并上调HMGA2,最终加速HCC细胞的肿瘤发生。
pre-microRNA
m6A修饰pre- microRNA的生物学意义主要是促进它们的生物学形成。目前的研究主要描述了以下机制:METTL3促进miRNA前体的剪接和成熟。METTL3催化的m6A修饰通过促进前microRNA的剪接触发miR143-3p的生物发生,导致肺癌脑转移。
METTL14
METTL14的催化结构域不含SAM,以封闭构象存在。METTL14和METTL3通过METTL3活性位点附近的一个环连接,形成稳定的1:1异二聚体结构,它具有更稳定和强大的m6A催化功能。METTL14的N端包含一个约500个氨基酸长的螺旋,与METTL13相互作用,并且在C端平行于N端螺旋的延伸实现了平衡和功能协调。METTL14增加了lncRNA中m6A甲基化修饰的水平,并改变了它们的稳定性。METTL14增加了m6A修饰的FAM225A的水平,增强了其稳定性。FAM225A作为ceRNA吸收miR-590-3p和miR-1275,最终上调靶基因ITGB3,促进鼻咽癌(NPC)细胞的肿瘤发生和转移。当被METTL14甲基化时,lncRNA作为分子支架并结合到m6A readers。METTL14催化LncPACERR的m6A修饰。LncPACERR作为分子支架与IGF2BP2结合,协同增强TAMs82中KLF12和C-MYC的稳定性。除了IGF2BP2外,METTL14催化的m6A修饰也可以被其他readers蛋白识别,如HuR、YTHDF1和YTHDF2。
METTL14沉默导致某些肿瘤中ncRNA表达增加。METTL14的下调增加了胃癌(GC)中circORC5的表达。CircORC5作为miR-30C-2-3p海绵,逆转mettl14诱导的miR30C-2-3p上调和AKT1S1和EIF4B下调,促进GC细胞生长和侵袭。mettl14介导的m6A修饰pri- microRNA的意义在于其前体成熟的增加。当被METTL14修饰时,pri- microRNA招募DGCR8并促进其成熟。METTL14介导pri-miR-211的m6A修饰,进而通过DGCR8沉默加速miR211的生物合成。通过靶向miR-211/TCF12轴,miR-211表达增加可降低T细胞淋巴母细胞淋巴瘤(T-LBL)中的细胞增殖。
METTL3/14
METTL3/14催化ncRNA的m6A修饰并稳定其转录本。修饰后的LncAROD稳定性增强,可直接结合SRSF3诱导PKM向PKM2转换。LncAROD作为一种抑制miR-145-5p的ceRNA,可增强HCC细胞的糖酵解、细胞增殖、迁移、侵袭和化学抗性。当METTL3/14协同催化m6A甲基化修饰时,ncRNAs作为分子支架促进各种复合物的形成。例如,circNDUFB2与TRIM25和igf2bp形成三元配合物,促进igf2bp的泛素化和降解,而igf2bp是促肿瘤因子。
WTAP
WTAP是一个剪接调节因子,包含一个扩展的N端螺旋线圈区域和一个非结构化的C端部分。WTAP的N端部分与METTL3的N端前导螺旋(LH)相互作用,使METTL3/14定位到核斑点上,并在RNA m6A甲基化中发挥重要作用。
WTAP促进ncRNA的甲基化修饰并有利于其稳定性。WTAP通过促进LncFOXD2AS1的m6A修饰来增强转录本的稳定性,FOXD2-AS1结合其靶FOXM1 mRNA形成复合物,促进后者的稳定性,最终促进骨肉瘤(OS)的发生。WTAP结合LncDLGAP1-AS1的m6A位点,提高其稳定性,DLGAP1-AS1吸收miR-299-3p,逆转WTAP mRNA的抑制,形成调控环,促进乳腺癌(BRC)对阿霉素(ADR)的耐药。
KIAA1429
KIAA1429是与m6A相关的最大因子,定位于NSs,并已被证明可招募METTL3、METTL14和WTAP来指导区域选择性甲基化。KIAA1429催化的m6A修饰通常发生在3 ' - UTR和终止密码子附近。与METTL3和METTL14类似,KIAA1429介导的m6A甲基化可能导致一些ncRNA的表达改变。在HCC中,KIAA1429催化circDLC1的m6A甲基化修饰,降低其表达水平,并通过改变circDLC1- huR- MMP1轴来促进肿瘤进展。
RBM15
RBM15通过直接结合RNA中的富集U的序列将MTC招募到其目标转录物上。RBM15特异性靶向ncRNA二级结构,如LncXIST的A-repeat区域。LncXIST的A重复区存在一个保守的AUCG四环发夹。RBM15通过结合A-repeat将write复合物招募到XIST进行m6A修饰,YTH结构域识别A-repeat (m6A) UCG四环中的m6A位点。XIST A -重复发夹RNA的(m6A) UCG四环由YTH结构域的弧形表面结合。在食管鳞状细胞癌(ESCC)中,RBM15以WTAP依赖的方式与METTL3相互作用,使m6A沉积在lnmalat1上。LncMALAT1结合YTHDC1作为分子支架,维持其核定位和相关癌基因表达,最终促进癌细胞转移。
受writer蛋白调控的ncRNA的异常m6A修饰影响肿瘤的发展。我们总结了甲基转移酶及其靶ncRNA在各种癌症中的作用(表1)。
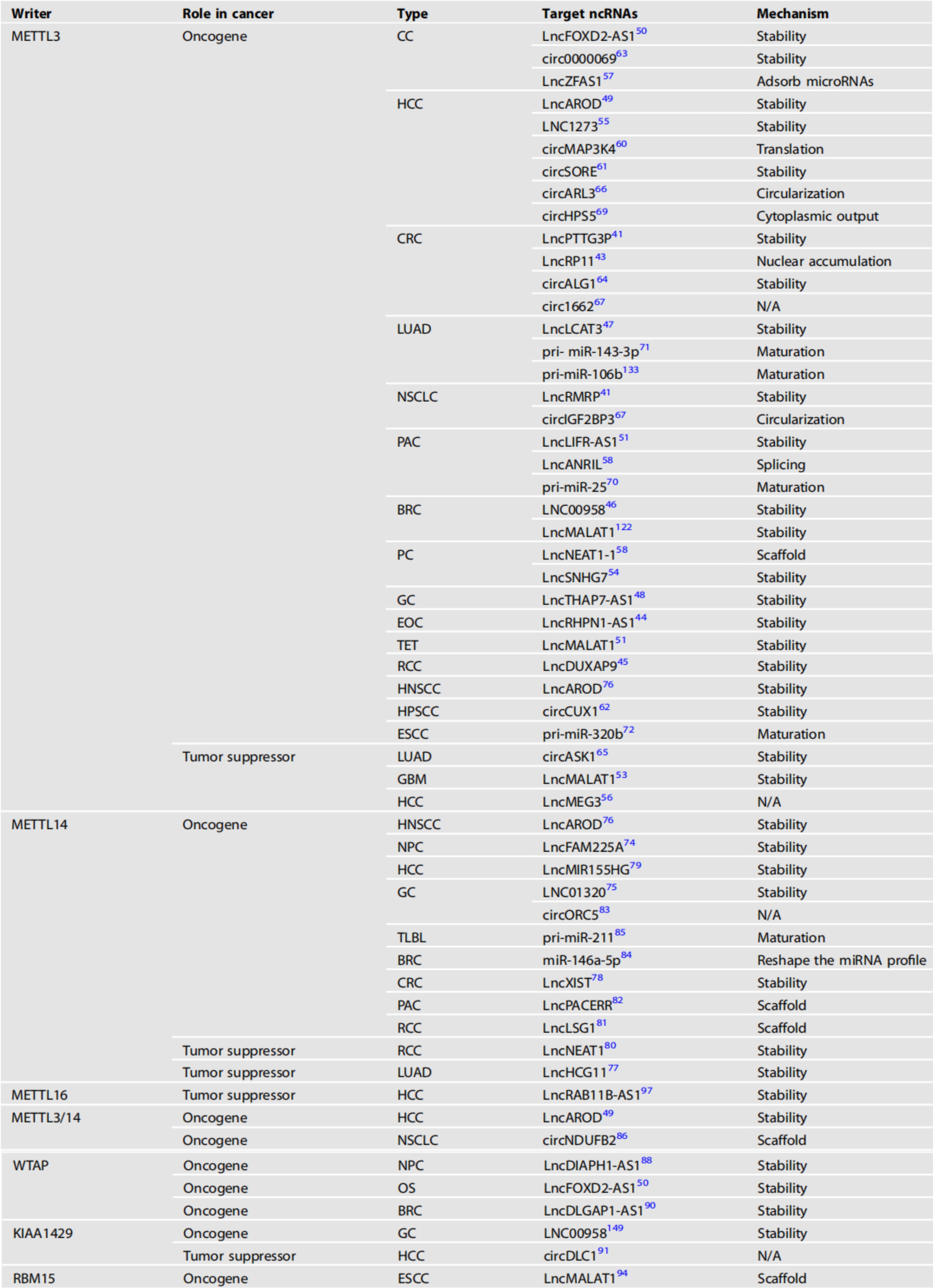
表1 甲基转移酶及其调控的ncRNA在各种癌症中的作用
CC:宫颈癌、HCC:肝细胞癌、CRC:结直肠癌、LUAD:肺腺癌、NSCLC:非小细胞肺癌、PAC:胰腺癌、BRC:乳腺癌、PC:前列腺癌、GC:胃癌、EOC:上皮性卵巢癌、TET:胸腺上皮性肿瘤、RCC:肾细胞癌、HNSCC:头颈部鳞状细胞癌、HPSCC:下咽鳞状细胞癌、ESCC:食管鳞状细胞癌、GBM:多形性胶质母细胞瘤、NPC:鼻咽癌、TLBL:细胞淋巴母细胞淋巴瘤
METTL16
SAM甲基转移酶METTL16的保守核由β-片、α-螺旋和310(η)螺旋组成。7股β-片的序为3214576,位于α和310 (η)螺旋簇之间。SAM和RNA的结合位点分别位于β-片的N端和C端。在一些ncrna中,如MALAT1, MALAT1 3 '端富含U的内部环与下游基因组编码的富含A的延伸相结合,形成一个由标准三元组组成的双体三螺旋:9个U•A -U, 1个C•G-C和一个C- G双链。三螺旋结构稳定了MALAT1并允许它在细胞中积累。METTL16识别MALAT195 3 '端的RNA三螺旋结构。与METTL3和METTL14类似,METTL16也通过诱导m6A对ncRNA进行催化修饰来影响ncRNA的稳定性。METTL16催化LncRAB11B-AS1的m6A修饰,降低其稳定性。当LncRAB11B-AS1表达下调时,HCC细胞的恶性表型受到抑制。
癌症中m6A erasers的调节异常
迄今为止,已经确定了两种类型的erasers,即FTO和ALKBH5。虽然erasers蛋白的种类很少,但在多种肿瘤中已经观察到它们的功能障碍。鉴于它们在癌症中的重要作用,我们列出了去甲基化的ncRNA(图2b)并解释它们的作用机制。
FTO
FTO是第一个被发现的RNA去甲基化酶,它的调节异常起着促进或抑制肿瘤的作用。在FTO的寡核苷酸结合区附近的两个环中,有两对带正电的残基与寡核苷酸样钳子结合。FTO的催化袋内链形成疏水袋,N6甲基稳定结合在该袋内氧化生成Fe(II)和α-KG。FTO擦除ncRNA的m6A甲基化修饰,最终通过m6A读取器抑制ncRNA的降解。在ESCC中,FTO去除LNC00022的m6A修饰,通过m6A读取器YTHDF2抑制LNC00022的降解,并通过加速P21泛素化和降解促进肿瘤增殖。FTO通过减少甲基化修饰来增加ncRNA的稳定性。当被FTO靶向时,LncHOXC13-AS上调并与CBP相互作用诱导FZD6上调,促进Wnt/β-catenin活化,最终导致宫颈癌(CC)侵袭性增加。
ALKBH5
与所有真核ALKBH5家族成员相似,ALKBH5的基本支架由8个反平行的β-片组成,二级结构基序对ALKBH5的催化功能至关重要。例如,基序1与ALKBH5酶的活性相关,其底物特异性由几个基序赋予,包括重要的活性位点协调残基HxD。H基序和基序2,它们特异性结合到m6A单链底物体上。ALKBH5增加ncRNAs的稳定性。在缺氧条件下,lncNEAT1的稳定性增加,因为其m6A修饰被ALKBH5消除,转录后抑制因子SFPQ从CXCL8启动子中的位置重新定位到副点,最终上调CXCL8/IL8并促进多型胶质母细胞瘤(GBM)的进展。相反,ALKBH5也会降低ncRNAs的稳定性。在PAC中,ALKBH5的下调允许去甲基化和LncKCNK15AS1的表达降低,从而抑制上皮-间质转化,导致肿瘤侵袭和转移。ALKBH5上调催化ncRNAs的水平。ALKBH5通过去甲基化上调circCPSF6, circCPSF6与PCBP2竞争性相互作用稳定YAP1 mRNA,促进HCC的恶性表型。ALKBH5通过去甲基化上调lnneat1的表达,导致多梳抑制复合物EZH2的一个亚基过表达,最终促进GC的恶性表型。由ALKBH5修饰的ncRNAs作为分子支架。ALKBH5催化LncTRERNA1的去甲基化并上调其表达。LncTRERNA1作为分子支架,通过H3K27me3修饰周期蛋白依赖性激酶抑制剂P21的启动子区域,募集EZH2并沉默其表达,从而促进弥漫性大B细胞淋巴瘤(DLBCL)的细胞增殖和细胞周期进展111。ALKBH5靶向的ncRNA分子具有沉默潜力。ALKBH5缺乏增加了miR-21-5p的m6A修饰水平,增加了miR-21-5p靶基因MAPK10、PTEN、SMAD7、PDCD4和SOX7在NSCLC112中的表达水平。
erasers蛋白催化的ncRNA m6A修饰的失调在肿瘤的发生和发展中起着重要作用。我们总结了去甲基化酶及其靶ncRNA在各种癌症中的作用(表2)。
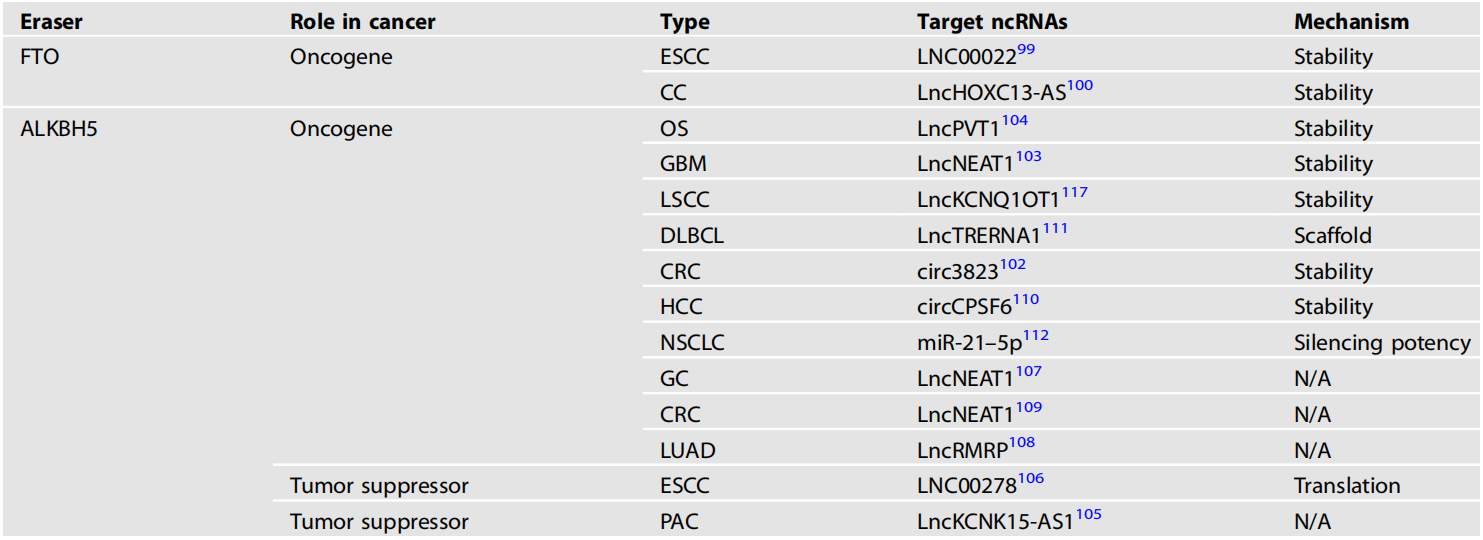
表2 去甲基化酶及其调控的ncRNA在各种癌症中的作用
ESCC:食管鳞状细胞癌、CC:宫颈癌、OS:骨肉瘤、GBM:多形性胶质母细胞瘤、LSCC:喉部鳞状细胞癌、DLBCL:弥漫性大b细胞淋巴瘤、CRC:结直肠癌、HCC:肝细胞癌、NSCLC:非小细胞肺癌、GC:胃癌、LUAD:肺腺癌、PAC:胰腺癌
到目前为止,我们不难发现ncRNA的m6A修饰失调,包括甲基转移酶引起的m6A修饰增加和去甲基化酶引起的m6A修饰减少,影响了各种癌症的发展。这些变化已在20多种肿瘤中观察到(图3)。

图3:m6a修饰的ncRNA在人类癌症中的调节异常
GBM:多形性胶质母细胞瘤、ESCC:食管鳞状细胞癌、LSCC:喉鳞状细胞癌、HNSCC:头颈鳞状细胞癌、UT尿路、RCC:肾细胞癌、BC:膀胱癌、PC:前列腺癌、LC:肺癌、NSCLC:非小细胞肺癌、LUAD:肺腺癌、HCC:肝细胞癌、PAC:胰腺癌、TET:胸腺上皮瘤、OS:骨肉瘤、HT:血液学系统癌、CML:慢性髓性白血病、TLBL:T淋巴母细胞淋巴瘤、DLBCL:弥漫性大B细胞淋巴瘤、CRC:结直肠癌、GNC:生殖系统癌、EEC:子宫内膜样子宫内膜癌、EOC:上皮性卵巢癌、CC:宫颈癌、GC:胃癌、BRC:乳腺癌、TC:甲状腺癌、NPC:鼻咽癌
癌症中m6A readers的调节异常
YTHDF1
YTHDF1的YTH结构域由5个α螺旋(α0-α4)、6个平行β链(β1-β6)和一个310螺旋组成。在这个YTH结构域中,C端β4 - β5和β1 - α1 - β2之间的环和N端α2之间的环形成了m6A结合域。由Trp411、Trp465和Trp470组成的芳香笼特异性识别m6a修饰位点。YTHDF1是所有readers蛋白中最通用和最健壮的;它识别G (m6A) C和A (m6A) C RNA序列,但没有序列选择性。YTHDF1结合ncRNA上的m6A位点,招募翻译机制,提高翻译效率。阴阳1 (YY1)结合微肽由m6A修饰的LNC00278在YTHDF1的帮助下翻译,阻断YY1与雄激素受体AR的相互作用,通过AR信号通路降低eEF2K的表达,增加caspase-3的水平,导致ESCC细胞凋亡。吸烟患者中ALKBH5介导的去甲基化抑制了这一过程,并最终介导了ESCC的恶性表型。
YTHDF2
YTHDF2的YTH区整体呈球形,中心有4条β-链(β1-β4),周围有4条α-螺旋(α1-α4),两侧各有侧翼区域。YTH表面具有丰富的碱性残基结构,其中β1链上的K416残基和连接体螺旋α3α4上的R527残基是结合m6A甲基所必需的。在邻近的疏水袋中,残基W432和W486参与了对m6A修饰的特异性识别。高通量测序结果显示,YTHDF1和YTHDF2没有序列偏好,对m6A位点的识别能力相同。YTHDF2与lncRNA中m6A修饰位点结合,促进其转录稳定性。在喉鳞状细胞癌(LSCC)中,ALKBH5水平降低导致lncKCNQ10OT1 m6A修饰增加,YTHDF2介导的lncKCNQ10OT1稳定性增强。lncKCNQ10OT1直接与HOXA9结合,进一步调控LSCC细胞的增殖、侵袭和转移。当m6A被YTHDF2识别时,ncrna被降解。METTL14诱导LncXIST的m6A甲基化修饰,并通过依赖YTHDF2的RNA降解降低XIST的表达,这在CRC的进展中起重要作用。同样,FTO降低了LNC00022的m6A修饰,YTHDF2结合减弱,通过抑制LNC00022的降解,加速了P21蛋白的泛素化和降解,从而促进了ESCC的增殖。
YTHDF3
YTHDF3是YTH家族的第三个成员,作为YTHDF1和YTHDF2的合作伙伴,通过识别m6A位点和影响RNAs的胞质代谢来促进翻译。通过识别m6A位点,YTHDF3改变ncRNAs的稳定性。LncDICER1-AS1通过将YY1转录因子募集到DICER1启动子上来促进其感觉基因DICER1的转录。DICER1促进miR-5586-5p的成熟,从而抑制糖酵解基因LDHA、HK2、PGK1和SLC2A1的表达。YTHDF3结合LncDICER1-AS1的m6A位点,促进其降解,最终增强PAC细胞的糖酵解作用。YTHDF3识别LncGAS5的m6A位点并促进其泛素介导的降解。LncGAS5含量降低后,其促进YAP降解的能力降低,YAP水平升高。YTHDF3是YAP的靶标,其水平随着YAP水平的升高而升高。这三者形成了一个促进CRC进展的调控环。
关于DF1/DF2是否具有独特的角色或冗余的角色,存在着激烈的争论。以前,不同的YTHDF类似物被认为与不同的m6A位点结合以执行不同的功能。然而,随着研究的进展,新的研究提出YTH结构域和所有m6A位点的结合是平等的,并且三个DF类似物在介导mRNA降解和细胞分化中起冗余作用。这些研究揭示了m6A功能的统一模型,其中所有m6A修饰的mRNA都受YTHDF蛋白的联合作用,与m6A位点的数量成比例。
YTHDC1
YTH结构域由5个α-螺旋(α0-α4)、6个β-链(β1-β6)和310个螺旋组成。m6A结合袋由一个β1残基、α1和β1之间的环、α1和β1以及连接β4和β5链的部分环组成,识别m6A修饰位点的芳香袋由W377、W428和L439组成。YTHDC1以依赖m6A的方式调节RNA代谢过程。YTHDC1通过识别ncRNA中的m6A位点,将癌基因定位到核点,放大癌基因的表达。MALAT1中的m6A位点作为将YTHDC1招募到NSs的支架,并促进ESCC94中关键癌基因的上调。YTHDC1结合ncRNA的m6A位点,促进其反向剪接和生物合成。METTL3过表达介导 circARL3的m6A修饰,YTHDC1结合m6A位点并促进其生物合成。circARL3作为ceRNA吸收miR-1305,导致WNT2、UBE2T、MDM2、TGF-β2和POLR3G下调,从而促进HBV + HCC细胞的生长。另一个例子是YTHDC1,它识别METTL3介导的circIGF2BP3中m6A修饰位点,促进circIGF2BP3环化。circIGF2BP3作为ceRNA吸收miR-328-3p和miR-3173-5p,上调PKP3的表达,从而破坏NSCLC68中的肿瘤免疫。YTHDC1促进ncRNA的核输出。YTHDC1促进ncrna的核输出。在YTHDC1的帮助下,m6A修饰的circMET被转运到细胞质中,通过增强CDKN2A mRNA的衰减、竞争性吸收miR1197和阻断SMAD3 mRNA的表达,促进NONO-TFE3 tRCC的生长。METTL3介导的m6A修饰增加了circHPS5的表达,而YTHDC1促进了circHPS5向细胞质的转运。这两者共同作用,增加circHPS5作为ceRNA吸收miR-370的能力,上调HMGA2,促进HCC的进展。
YTHDC2
YTHDC2通过调节RNA代谢影响肿瘤进展。YTHDC2通过调节RNA代谢影响肿瘤进展。YTHDC2与m6A修饰的mRNA结合并促进其降解。m6A修饰的SLC7A11 mRNA与YTHDC2结合,增强YTHDC2降解,减少胱氨酸摄取,从而阻断下游抗氧化程序,最终抑制LUAD131的进展。此外,YTHDC2结合mRNA促进其翻译起始。YTHDC2结合IGF1R mRNA,促进其翻译起始,激活IGF1R- akt /S6轴,最终导致鼻咽癌耐辐射。然而,没有研究表明YTHDC2在ncRNA m6A修饰中的作用。
IGF2BP1
IGF2BP1是第一个被描述的IGF2BP家族成员,由六个典型的结合域组成,包括四个促进RNA结合的C端K同源(KH)结构域和两个促进IGF2BP-RNA复合物稳定性的n端RNA识别结构域(RRMs) 。IGF2BP1结合ncRNA中的m6A位点,增加其稳定性。IGF2BP1识别circMDK中的m6A修饰位点,从而增加其转录本的稳定性。circMDK抑制miR-346, miR-874-3p上调自噬相关的ATG16L1,从而激活PI3K/AKT/mTOR信号通路,促进HCC细胞增殖、迁移和侵袭。METTL3和IGF2BP1共同作用,通过m6A修饰增加LncAROD的稳定性。升高的LncAROD增加了缺氧环境或HIF1α中丙酮酸激酶异构体M2 (PKM2)的水平,并促进HCC的进展。
IGF2BP2
IGF2BP2在多种组织中广泛表达,是多种癌症类型的独立预后因素;它通过识别参与癌症发生和生长的不同类型RNA(如miRNA、mRNA和lncRNA)的m6A位点起作用。IGF2BP2增加ncRNAs的稳定性。例如,IGF2BP2识别并稳定携带m6A甲基化的LncDANCR,然后,这些分子共同作用促进PC的进展。IGF2BP2也有助于形成多重复合物。m6A甲基化修饰的circNDUFB2作为支架,与TRIM25和igf2bp形成三元复合物,促进NSCLC促进因子IGF2BPs的泛素化和降解。当circNSUN2被METTL3修饰m6A时,在YTHDF2的帮助下,其向细胞质的转运增加。CircNSUN2进入细胞质,形成CircNSUN2 /IGF2BP2/HMGA2 RNA蛋白三元复合物,增加HMG mRNA的稳定性,增强CRC恶性。
IGF2BP3
与IGF2BP1类似,IGF2BP3仅在健康成人的少数组织和细胞中表达,但在多种肿瘤中被重新合成或大幅上调。因此,在某种程度上,它们可以被表征为癌胎基因。IGF2BP3识别并结合ncRNA的m6A位点,提高ncRNA的稳定性。IGF2BP3通过结合m6A甲基化修饰位点增加LncKCNMB2-AS1的表达。上调的LncKCNMB2AS1作为miR-130b-5p和miR-4294的竞争内源性RNA,最终促进CC的进展。
hnRNPs
异质核糖核蛋白(hnRNPs)是一类RNA结合蛋白(RBDs)。hnRNP蛋白中有四个独特的RNA结合结构域(RBDs): RNA识别模式(RRM)、准RRM、构成RGG盒的富含甘氨酸结构域和KH结构域。RRM是最常见的RBD,它包括两个保守的RNP1八聚体和RNP2六聚体序列,以及4个β-片和2个α-螺旋(βαβαβ),这对RNA结合特异性至关重要。hnRNPs在核酸代谢的许多方面发挥重要作用。hnRNP A2B1通过读取pri-miR-106b中的m6A位点促进miR-106b-5p的成熟,从而降低分泌卷曲相关蛋白2 (SFRP2)的水平,激活Wnt/β-catenin信号通路,促进LUAD肿瘤的发生。hnRNP A2B1与LncRP11的m6A位点结合增加其核积累并募集Siah1和Fbxo45 mRNA。Siah1和Fbxo45两种E3连接酶的mRNA降解增强,阻止Zeb1蛋白酶体降解,最终促进结直肠癌的恶性表型。
HuR
HuR是一种RNA结合蛋白,通过RRM1和RRM2两个RNA识别基序识别不同RNA中富含U/ au的元件。RRM结构域采用β1-α1-β2-β3-α2-β4拓扑结构,两个α-螺旋在反平行的四链β片上堆叠。位于β链1和3上保守位置的残基对RN结合至关重要。HuR在转录后水平严格调控靶RNA的命运。HuR与ncRNA的m6A位点结合以稳定其转录53,79。肠道细菌的脂多糖(LPS)上调METTL14,促进LNMIR155HG甲基化,并以HuR依赖的方式稳定它。LNMIR155HG作为ceRNA通过miR-223/STAT1轴诱导PD-L1表达,在HCC79的免疫逃逸中发挥重要作用。
EIF3
真核生物的翻译起始依赖于许多真核起始因子(eIFs),这些因子刺激起始tRNA、Met-TRNAiMet和mRNA募集到40S核糖体亚基,随后扫描mRNA寻找AUG起始密码子。EIF3是20世纪70年代发现的首批启动因子之一,它在几个EIF3之间组织了一个相互作用的网络。研究发现,circRNA作为ncRNA,不具备翻译成蛋白质或多肽的能力,但当它们经过m6A修饰,EIF3结合m6A位点时,一些ncRNA可以被翻译。当EIF3结合到circARHGAP35起始密码子的m6A修饰位点时,产生一个包含四个FF结构域且缺乏Rho GAP结构域的截断蛋白,该蛋白通过与细胞核中的TFII-I蛋白相互作用促进肿瘤进展。
在ncRNA的m6A修饰被writers安装或被擦除后,readers蛋白与这些分子结合的能力发生了变化,这些ncRNAs的代谢命运由不同的机制决定(图4)。我们总结了读取器蛋白及其靶ncRNA在各种肿瘤中的作用(表3)。
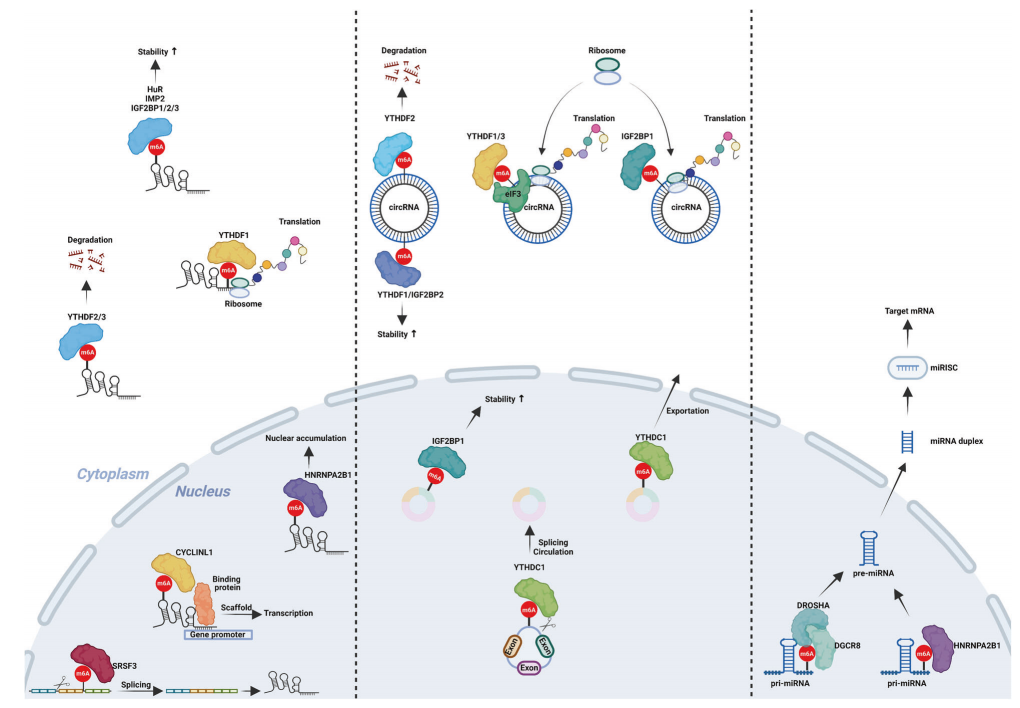
图4:m6A修饰在非编码RNA中的作用
环状RNA中m6A修饰的功能(左):包括反向剪切、稳定性改变和增强细胞质运输;这些环状RNA也能够被翻译。
m6A修饰lncRNA的功能(中):包括剪接、充当分子支架、核积累、稳定性改变等,这些lncRNA也可以翻译。
m6A修饰的功能(右):主要是促进其成熟。
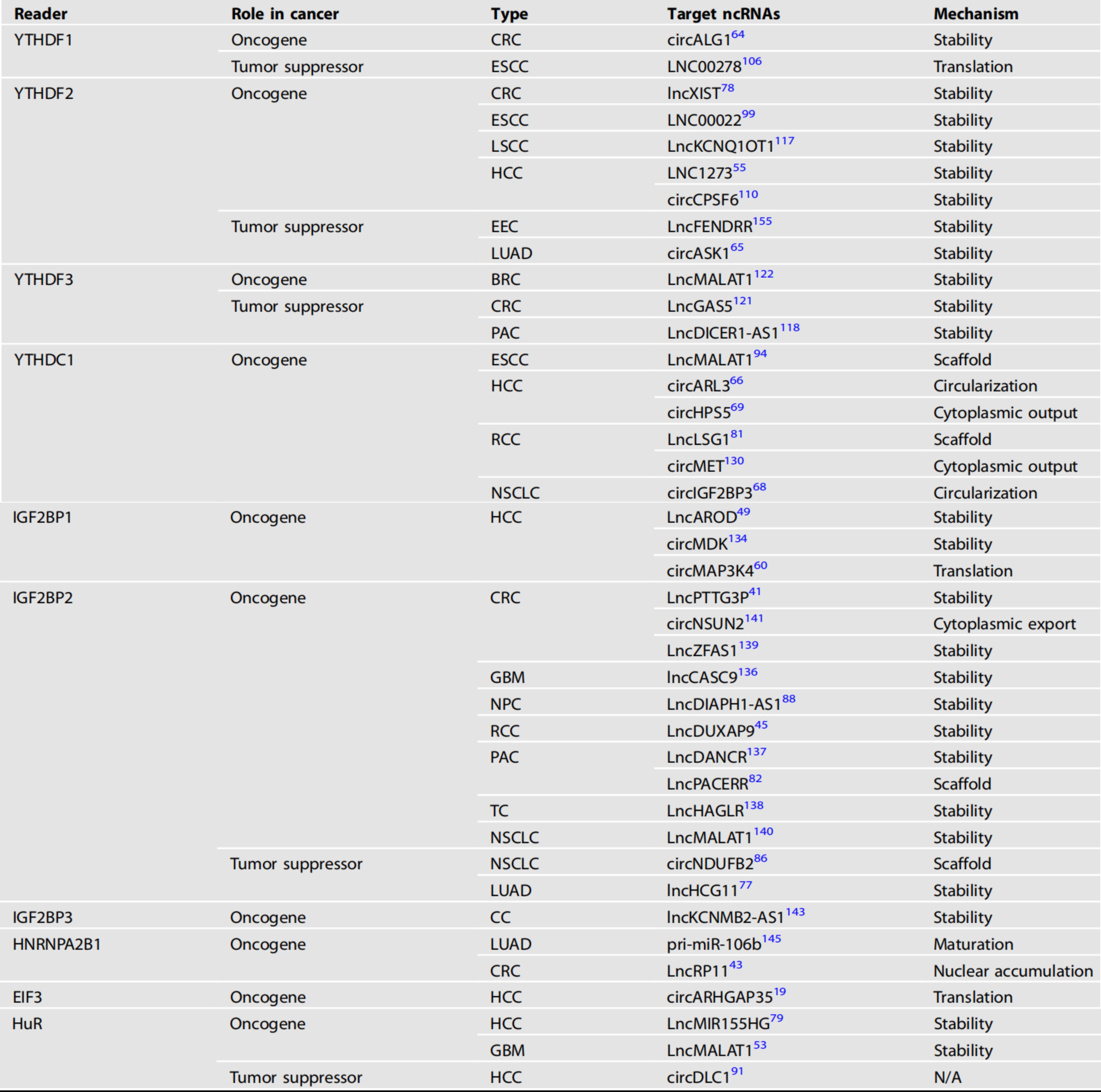
表3:癌症中m6a结合蛋白的调节异常
CRC:结直肠癌、ESCC:食管鳞状细胞癌、LSCC:喉部鳞状细胞癌、HCC:肝细胞癌、EEC:子宫内膜样子宫内膜癌、LUAD:肺腺癌、BRC:乳腺癌、PAC:胰腺癌、RC:肾细胞癌、NSCLC:头颈部鳞状细胞癌、GBM:多形性胶质母细胞瘤、NPC:鼻咽癌、TC:甲状腺癌、CC:宫颈癌
看了以上介绍,您是不是对m6A修饰有了更全面的了解呢?想要获得更多文章介绍,请点击下方链接
Nature子刊| 重磅综述!一文总结「m6A修饰非编码RNAs」在各类肿瘤中的调控机制及作用
上海云序生物多年来长期专注于RNA修饰测序,针对m6A修饰研究拥有成熟的测序技术和专业的生信团队,能够助力您快速筛选RNA修饰靶基因,深度解析m6A修饰的调控机制!
快来和云序一起行动起来吧,解锁更多m6A修饰的奥秘!
