题目:Heterochromatin drives compartmentalization of inverted and conventional nuclei
期刊:Nature
影响因子:41.577
主要技术:Hi-C、Cryosections 、immunostaining、FISH 、microscopy
哺乳动物细胞中常染色质和异染色质存在空间上的分离,但区室化的形成机制尚不清楚。本研究对夜行哺乳动物的视杆细胞倒置核进行Hi-C分析并结合显微镜和多聚体模拟,发现异染色质区域间的吸引对建立区室化及着丝粒周边异染色质,可调节性异染色质和常染色质的建立至关重要。倒置细胞核中加入异染色质和核纤层的相互作用可重建传统细胞核中的组织。
文章思路
研究内容及结果
1. 常规和倒置核的显微镜观察及Hi-C分析
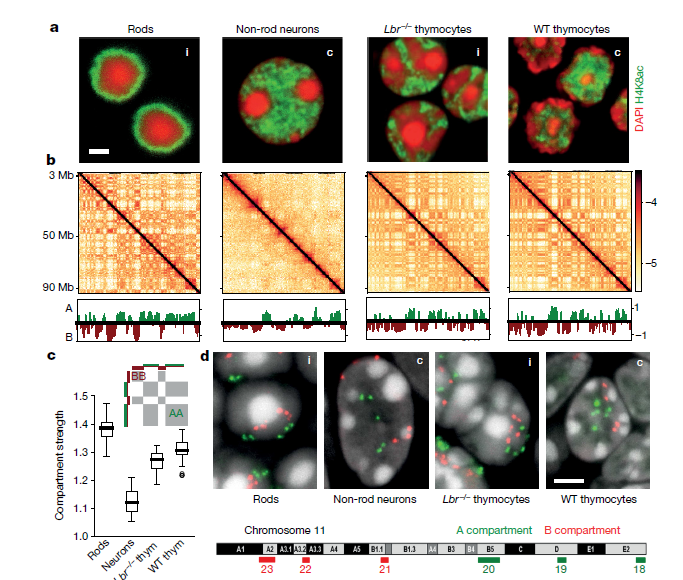
为了研究基因组区室化的机制,作者对初生组织中分离的四种小鼠细胞类型中进行了Hi-C实验。这四种细胞类型均具有常规或倒置核结构:杆光感受器(倒置),非杆视神经元细胞(常规),野生型胸腺细胞(常规)和无效核纤层蛋白B受体胸腺细胞(Lbr - / -)(倒置)(Fig. 1a)。常规核和倒置核从显微镜中可以看出核组织的巨大差异(Fig.1a),但是染色质组织特征中的拓扑结合域(TAD),染色体区域和区室均类似(Fig1.b),在单细胞Hi-C中也发现上述特点。
随后,作者研究了常染色质和异染色质在空间定位上的差异是否会影响Hi-C中所见的核区隔,从Hi-C图中计算了隔室剖面(Fig.1b),并将隔室化程度定义为隔室之间接触的富集程度。在倒置核中,胸腺细胞的分隔程度仅略有降低,但在杆状细胞中则变得更强(Fig.1c)。
Fig.1常规和倒置核的显微镜观察和Hi-C分析
综上所述,分析表明,尽管在倒置时单个A或B室的空间位置发生了变化,但仍保留了分区的程度(Fig.1a, d),表明其分区的机制不能严格依赖于核层。为了协调倒置核与常规核的Hi-c区室的划分与这些核中不同空间几何形状之间的关系,作者寻求一种满足以下三个标准的划分机制。1、它应该重现倒置的核,通过显微镜定量定义不同类型染色质的径向位置和Hi-C技术区分区室化的强度。2、它应该重现常规的核,当引入异染色质和核层之间的有吸引力的相互作用时,常规的核的特征是在Hi-C中显示类似程度的区室化,但是在显微镜观察下区室的空间位置明显不同。3、它应该是基于合理的生物上和物理上的力,这就限制了不同类型的染色质与核层的染色质之间的相互作用。
2. 倒置的核的形态限制了可能的区室化模型
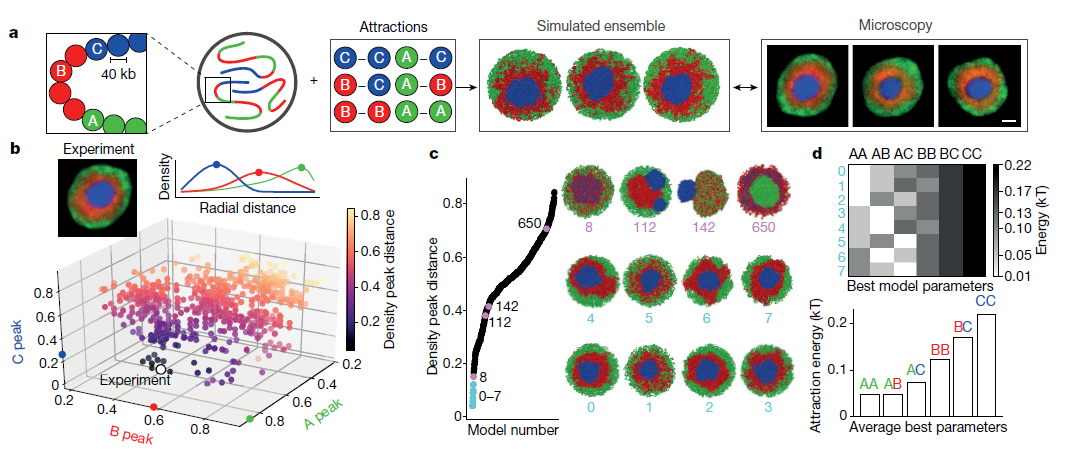
为测试区室化的机制,作者开发了染色质的平衡聚合物模型,其代表染色体作为嵌段共聚物(Fig.2a),类似于其他分离的分离模型。扩展以前的两种模型,作者模拟使用三种类型的单体:常染色质(A)异染色(B)和中心体组成型异染色质(C)。作者模拟了8条染色体;每条染色体由6,000个单体组成;每个单体代表40kb染色质;在球形核中以35%的体积密度分布。A和B单体的序列反映倒置的核的Hi-C数据中的区室化。为了表示Hi-C中无法显示的中心区域或染色体中心,作者在每个染色体近端放置了1块C单体(长度为染色体的16%)。所有单体都排除了体积,并根据其染色质类型的短距离成对吸引。给定六个成对吸引参数(A-A,A-B,B-B,B-C,C-C和A-C),所有可能的吸引强度排列都指定720(6)类模型(参见方法)。为了限制可能模型的空间,作者首先定量地将所有720类模型与显微镜观察的数据进行比较。 具体而言,作者计算了A,B和C单体的径向分布,并将模拟中获得的分布与显微镜中获得的分布进行了比较(Fig.2b)。大多数模型类型与显微镜中观察到的倒置核的同心几何形状不一致(Fig.2c)。 例如,过强的B-C相互作用导致B和C混合(Fig.2c,模型8和扩展数据Fig.6a-c),而相对较弱的B-C相互作用导致C单体染色体从a中排出B单体的中心质量(Fig.2c,模型112)。过强的A-A相互作用倾向于促进大的常染色质小球的形成(Fig.2c,模型650和扩展数据Fig.6d-f)。
以上结果表明,与常染色区域的活动相关的聚类是作为区域化基础的主要机制。只有八类模型可以重现实验观察到的倒置几何形状(Fig.2b,c)。作者专注于最合适的模型类型,并进一步简化这些模型,将C-C固定得足够高以诱导C单体的中心球,A-A始终是远小于B-B(扩展数据Fig.7d),并且所有交叉项都是各个纯项的几何平均值(例如,A-B =(A-A×B-B)1/2) ,从而满足Flory-Huggins相分离标准。 这使得B-B吸引力成为唯一的自由参数。
Fig.2 倒置的核的形态限制了可能的区室化模型
3. 基于异染色质的机制定量地再现倒置和常规核
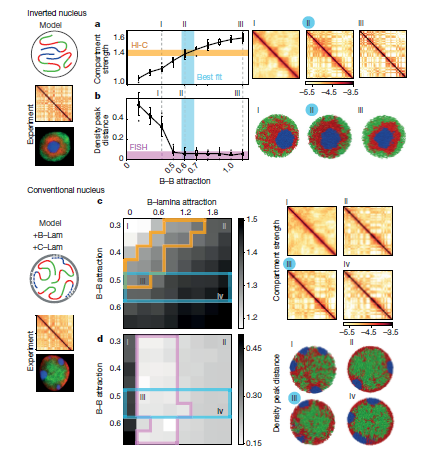
接下来,作者再现显微镜图像中看到的反转核的异染色质主导模型,测试其是否可以同时再现在Hi-C数据中观察到的区室化。通过确定相互作用强度的顺序,作者发现了一系列B-B吸引的模型可以定量再现Hi-C数据和显微镜观察(Fig.3a,b)。作者通过对倒置核的分析揭示的异染色区域之间的吸引力的中心作用,与此形成对比观点认为异染色区域间相互作用取决于同染色区域之间相互作用,或者是同作为分隔作用主要驱动力是薄层之间相互作用的。异染色区域之间更强的吸引力与最近观察到的异染色区域相关组蛋白甲基化在决定染色体力学性能方面的主导作用是一致的。
为了将作者的模型扩展到传统的原子核中,其表示了具有短程吸引的异染色质-薄层相互作用(B-Lam引力,Fig.3c, d)。为了对实验中发现的不同染色体进行建模,作者将c单体簇固定在薄层上随机的位置。固定不需要在一段时间内保持不同的染色体中心,但需要在平衡模拟中保持它们的分离(补充视频1)。通过全面的B-B和B-Lam吸引物,作者发现他的模型可以同时重现显微镜图像中观察到的活性和非活性染色质的空间定位,以及野生型胸腺细胞在Hi-C数据中观察到的区室化。尽管再现显微镜数据需要足够强的B-Lam而不进一步限制这些参数,同时再现在Hi-C数据中观察到的区室化会缩小B-Lam和B-B吸引力的范围(Fig.3c,d)。值得注意的是,常规核的最佳拟合B-B吸引区域包含最适合倒置核的B-B吸引力。由于组蛋白修饰与倒置和常规细胞核中相同类型的染色质相关,作者谨慎地假设B-B吸引力在两种核类型中保持相同。通过这种约束,作者可以缩小可能的B-Lam值的范围(约0.3kT;Fig.3c),并发现B-Lam吸引力应该与B-B吸引力相当。总之,作者的模拟表明两者都是由倒置和常规细胞核主要由异染色质 - 异染色质吸引力控制,而异染色质 - 薄层吸引力控制全局空间形态。
Fig.3异染色质为基础的机制定量复制倒置核和常规核
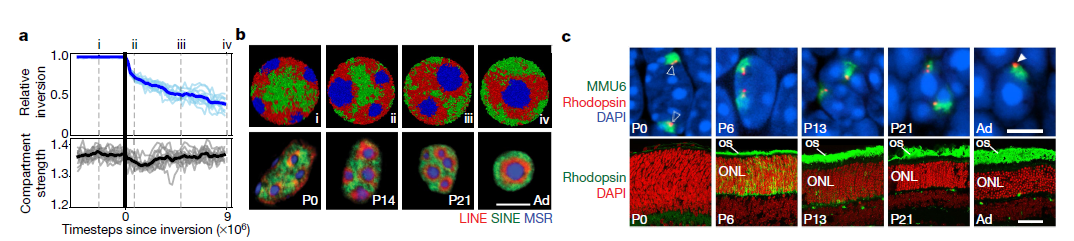
4. 隔室强度在核反演过程模型和实验中的时间演化和维持过程。
为了验证作者提出的划分机制,作者模拟了一个核反转的时间过程(Fig.4a, b),为此,作者关闭了模拟常规核中薄片-异染色质的相互作用,并观察到了自发核反转(Fig.4b)。值得注意的是,模拟的时间过程反映了活跃的杆分化过程中的关键 (Fig.4b)。B和C单体在模拟中经历不可逆的液体状融合,类似于其他相分离系统(Fig.4b)。在模拟中,虽然在异染色质离开薄层后,区隔分离会暂时下降(Fig.4a),但在整个反转过程中,区隔仍然是分离的。在显微镜显示在棒状的核转化的整个过程期间,个体基因组位点与其自身区室类型的染色质一起重新定位。例如,视紫红质基因座仍与常染色质(A区室)相关,并且视紫红质受体在整个翻转过程中保持表达(Fig.4c)。为了进一步测试作者提出的分区机制,从倒置几何中初始化模拟并重新引入薄层-异染色质相互作用。这些模拟预测只有部分去反转:而B单体取代了核周边的A单体,C单体仍然是由B单体包围并与薄层相关的单个大小球。
Fig.4 隔室强度在核反演过程模型和实验中的时间演化和维持过程
文章小结
哺乳动物细胞中常染色质和异染色质存在空间上的分离,但区室化的形成机制尚不清楚。本研究对夜行哺乳动物的视杆细胞倒置核进行Hi-C分析并结合显微镜和多聚体模拟,发现异染色质区域间的吸引对建立区室化及着丝粒周边异染色质,可调节性异染色质和常染色质的建立至关重要。倒置细胞核中加入异染色质和核纤层的相互作用可重建传统细胞核中的组织。
解析文献
Martin Falk, et al. Heterochromatin drives compartmentalization of inverted and conventional nuclei [J]. Nature, 2019, 570, pages395–399.
相关服务
Hi-C是以整个细胞核为研究对象,利用高通量测序技术,结合生物信息分析方法,研究全基因组范围内整个染色质DNA在空间位置上的关系,获得高分辨率的染色质调控元件相互作用图谱。Hi-C可以与RNA-Seq、ChIP-Seq、ATAC-Seq等数据进行联合分析,从基因调控网络和表观遗传网络来阐述生物体性状形成的相关机制。
武汉金开瑞生物工程有限公司提供的Hi-C技术,是一种新型、高效、经济的研究方法,帮助您解析基因组三维结构。
如何低成本研究空间转录组?看完这篇文章你或许会有答案
(2022-06-02T14:51 浏览数:8728)
【周二晚八点】从位置到功能--空间转录组应用
(2022-05-16T08:59 浏览数:9474)
Cell Reports:利用空间转录组解析哺乳动物精子生成
(2022-04-28T14:54 浏览数:11169)
RNA二级结构调控基因表达的研究现状和进展
(2022-04-21T13:39 浏览数:8593)
Nature: MERFISH绘制小鼠初级运动皮层空间细胞图谱
(2022-04-18T13:24 浏览数:7674)
大自然的恩赐-外泌体药载
(2022-04-08T13:43 浏览数:8809)
【详解】基于图像的单细胞空间分辨转录组学技术
(2022-04-01T11:18 浏览数:12792)
知无不“研”,五分钟带你了解空间分辨转录组学的前世今生
(2022-03-18T14:00 浏览数:9576)
唾液外泌体与临床疾病的关联研究
(2022-03-11T16:36 浏览数:7966)
唾液外泌体与临床疾病的关联研究
(2022-03-11T16:36 浏览数:8373)