
过量摄入糖分越来越多地被认为是导致肥胖和相关心脏代谢疾病流行的原因之一。糖以蔗糖或高果糖玉米糖浆形式添加到饮食中,两者都包含几乎等量的葡萄糖和果糖。果糖代谢和其衍生代谢物的特性使果糖成为正常膳食糖消耗的生理信号。当果糖摄入过量时,这些特性可能会导致心脏代谢疾病。本研究回顾了果糖代谢的生物化学、遗传学和生理学相关研究,揭示了过量摄入果糖可能导致代谢疾病的机制,并提出治疗代谢疾病的新治疗方案。相关成果发表于《Cell Metabolism》。
甜味感知
动物进化出复杂的机制来感知糖分并促使其消耗。单糖(包括葡萄糖和果糖)以及双糖(如蔗糖)可激活位于舌头和上颚上皮细胞G蛋白偶联受体Tas1R2和Tas1R3。这些受体刺激神经元回路,投射到参与处理享乐和厌恶刺激的杏仁核区域。除了甜味感知机制,也有存在促进含糖食物消耗机制。Tas1R2和Tas1R3缺乏小鼠无法尝到糖或其他甜味剂的味道,但它们更喜好葡萄糖(而不是果糖或其他无热量甜味剂)含量高的食物。这种偏好需要肠钠-葡萄糖共转运蛋白(SLC5A1,也称为SGLT1),这是由肠细胞和肠内分泌细胞表达的主要转运蛋白,负责通过肠腔膜摄取葡萄糖和半乳糖。SGLT1依赖性的糖消耗由迷走神经携带的信号介导,以激活孤束触觉尾侧核内的神经元。在另一种无味觉遗传小鼠模型研究中发现缺少味觉细胞向味觉神经发出信号所需的P2X2和P2X3嘌呤能受体。这些研究表明,果糖可以提高糖的消耗量,而不受口味的影响。甜味感觉和糖分摄入后感知的结合可能会相互作用,从而提高对富含糖分食物的偏好。
过量摄入果糖会导致代谢疾病
早期研究发现高果糖饮食可以在几天内诱发高甘油三酯血症,比相同含量淀粉或葡萄糖饮食更强烈,这使人们对果糖作为代谢疾病的促因产生兴趣。高果糖饮食可诱发许多代谢障碍特征,包括高血压,这是代谢综合征的典型特征,也被称为心脏代谢疾病综合征。近年来的干预研究表明,过量摄入中-高剂量的果糖会对人体代谢结果产生不利影响。并且不同糖之间(如葡萄糖和果糖)或糖和其他饮食营养素(包括脂肪和蛋白质)之间可能存在复杂的相互作用从而影响代谢健康。尽管含有果糖的添加糖会对健康产生负面影响的证据令人信服,但这些不利影响是完全通过增加能量摄入以促进体重增加的影响还是通过独立于肥胖的机制尚不清楚。
尽管文献主要关注糖含量增加导致的健康风险,但糖暴露模式也可能影响其生物学效应。动物研究发现以液体形式提供的糖可能比固体食物形式影响更大。每天大剂量单次摄入可能比频繁摄入少量果糖更有害。此外,有证据表明运动期间补充果糖有助于保持精力充沛,因此推测果糖在久坐人群中的不利影响会放大。
果糖吸收与肠道
果糖摄入后,果糖通过胃肠道进入小肠,通过肠上皮细胞刷状缘上的转运体被吸收。GLUT5(也称为Slc2a5)对果糖比葡萄糖具有更显著的特异性,果糖的亲和力(Km 6-15mM)范围较广。GLUT5在小肠管腔膜上高水平表达,在基底外侧膜上表达较少。其表达和活性在近端十二指肠中最高,并沿小肠长度下降。GLUT5对膳食果糖的肠道吸收至关重要,果糖转运进入肠细胞的水平与肠细胞腔膜的浓度梯度成正比。这与肠道葡萄糖吸收形成对比,后者由钠连接的协同转运蛋白SGLT1介导,SGLT1可以有效地将葡萄糖泵入肠细胞,对抗浓度梯度。因此肠道葡萄糖吸收比果糖更快、更彻底。不过,肠上皮细胞稳定的果糖磷酸化对于维持管腔-肠细胞果糖梯度以促进果糖吸收更完全很重要。与葡萄糖在小肠内几乎完全吸收相比,肠内果糖转运能力会达到饱和状态,一部分果糖会到达大肠被肠道微生物群分解代谢。GLUT5也会在其他组织和细胞类型中表达,包括骨骼肌、前脂肪细胞、前列腺、精子和红细胞,然而果糖转运到这些组织中的重要性仍不清楚。
介导葡萄糖和果糖通过肠细胞基底外侧膜流出机制目前还不太确定。GLUT2(也称为 Slc2a2)可促进葡萄糖和果糖流出,GLUT2在近端小肠细胞基底外侧膜上高水平表达。GLUT2是一种低亲和力、高容量转运蛋白促进葡萄糖和果糖转运,对两种糖类具有相似的亲和力 (Km~11 mM)。然而,GLUT2缺乏的人类或小鼠中葡萄糖外流没有明显受损,是基于微粒体膜转运途径的胞吐作用作为替代方案在跨细胞单糖流出中发挥主要作用。
果糖介导的肠道GLUT5表达诱导依赖于肠道果糖代谢。响应膳食果糖诱导肠道GLUT5表达是由碳水化合物反应元件结合蛋白(ChREBP,也称为 Mlxipl)介导,该蛋白是一种在肠上皮细胞和其他关键代谢组织高水平表达的碳水化合物感应转录因子。果糖吸收情况在儿童和成人中变化很大,这取决于年龄、膳食糖暴露以及可能的其他未确定的遗传、饮食和环境因素。尽管 GLUT5基因敲除会导致小鼠果糖吸收不良,但临床上果糖吸收不良与肠道 GLUT5 表达降低没有必然联系。硫氧还蛋白相互作用蛋白 (TXNIP)是另一种ChREBP调节的果糖诱导蛋白,在肝脏和肠道等关键代谢组织中表达。TXNIP有助于促进性己糖转运体在质膜上的定位,包括GLUT5在肠细胞管腔膜上的定位。因此,除了调控GLUT5表达外,调节GLUT5适当定位和功能的因素也可能是膳食果糖吸收的重要决定因素。但目前尚不清楚肠道果糖吸收或肝脏果糖代谢的自然变化是否会导致果糖诱导的心脏代谢疾病。
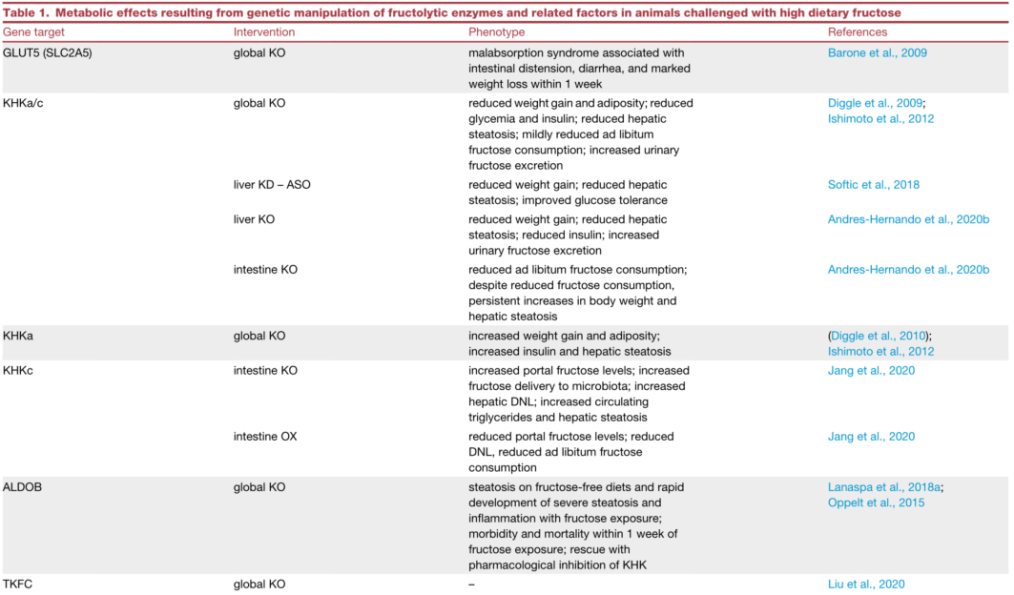
果糖代谢与肠-肝
哺乳动物葡萄糖与果糖代谢的先天差异反映在血液水平上的显著差异。外周血中正常空腹血糖浓度为~5 mM,而果糖浓度低于~0.02 mM。葡萄糖耐量试验期间,摄入大量葡萄糖的健康个体外周血糖水平可达~7.5 mM。而大剂量口服果糖会暂时增加其外周循环果糖水平,峰值达~1mM,随后在数小时内迅速恢复到微摩尔水平。大量口服果糖后,外周循环果糖水平没有出现相对较大的增加,说明肠道有能力代谢摄入的大部分果糖,外周循环逸出量相对较少(图 1)。
传统观点认为肝脏是果糖清除的主要部位。然而,稳定同位素研究中发现,灌胃果糖的小鼠(剂量为0.5 g/kg体重),~90%吸收的果糖在小肠内代谢,到达肝脏的量相对较少。肠内代谢的果糖在门静脉中以葡萄糖或其他果糖衍生代谢产物的形式出现,如乳酸、丙氨酸、甘油酸和其他有机酸。小肠表达完整的糖异生酶,能够将摄入的果糖转化为循环葡萄糖。除小鼠外,肠道果糖代谢是否占主导地位尚不清楚。不过,肠道果糖代谢的相对重要性可能因物种而异,如大鼠和人的肠道GLUT5表达明显高于小鼠,因此需要更多研究来阐明肠道与肝脏果糖代谢的重要性。尽管如此,这些研究得出一个新的重要概念,即肠道果糖代谢可能会保护肝脏免受过度暴露膳食果糖的影响。
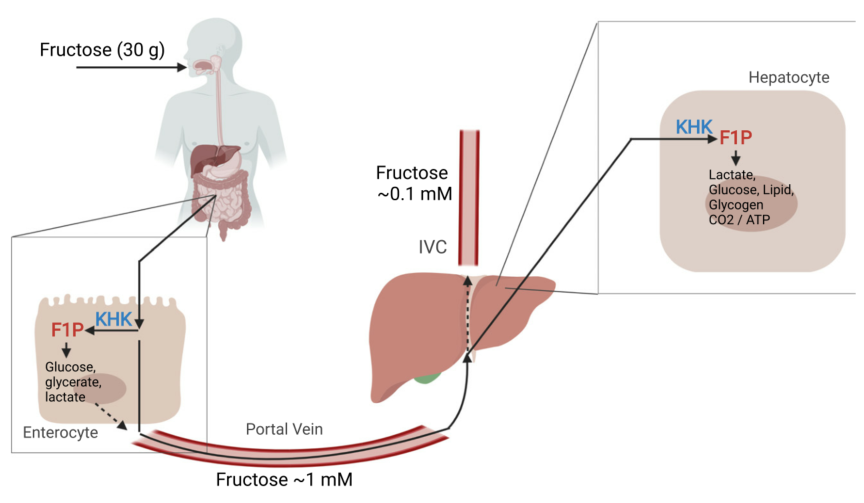
图1. 肠道中果糖代谢和首次摄取
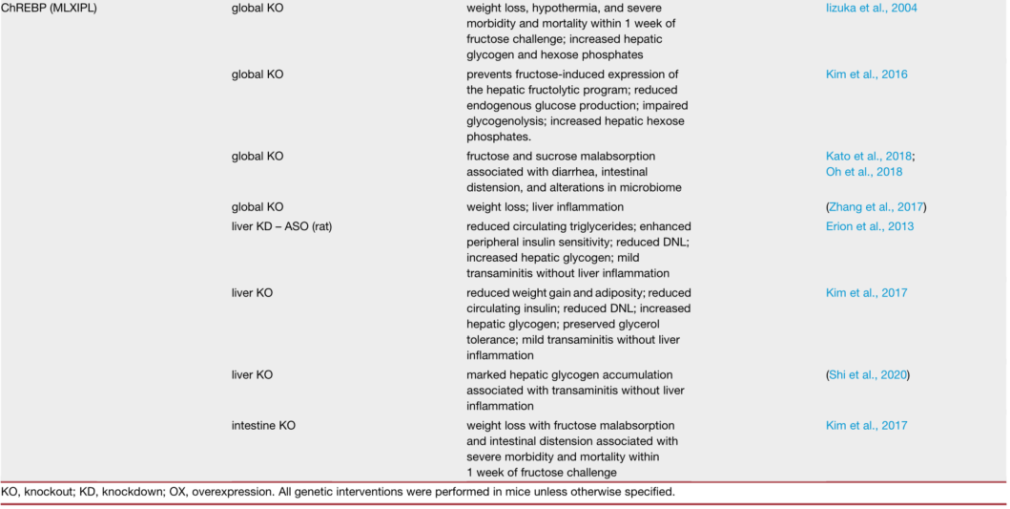
细胞间果糖代谢
果糖跨细胞膜转运依赖肠细胞中己糖载体,如GLUT5。在肝脏(果糖代谢的另一个主要部位)中,GLUT5表达水平不高,而GLUT2可能是葡萄糖和果糖的主要膜转运蛋白。GLUT8(也称为 Slc2a8)也对果糖具有亲和力,它有助于肠细胞和肝细胞中果糖转运。果糖进入细胞后,由三种果糖分解酶进行级联代谢(图2)。这些果糖分解酶有效地将己糖果糖转化为磷酸三糖,磷酸三糖通过糖酵解和糖异生作用生成。第一步,果糖在酮己糖激酶(KHK,也称果糖激酶)催化下快速且不可逆的磷酸化生成果糖-1-磷酸(F1P)。该代谢物专用于果糖分解途径,不与糖酵解或糖异生共享。与葡萄糖相比,果糖是己糖激酶 I、II 和 III 的不良底物(葡萄糖 Km< 0.1 mM;果糖Km~1-10 mM)。在常规循环浓度下,葡萄糖通过这些己糖激酶有效抑制果糖代谢。与许多其他己糖激酶不同,KHK不受ATP变构抑制及其他细胞能量信号抑制,也不受其直接产物抑制。由于KHK对果糖的Km较低且活性较高,同时缺乏对其活性的调节,大部分通过门静脉循环到达肝脏的果糖很容易被摄取,很少到达体循环。
KHK介导的果糖磷酸化对ATP消耗非常强烈,大量果糖的静脉输入会导致肝细胞ATP与AMP比率急剧下降,并且游离磷酸盐用于合成F1P而显著下降。F1P可在肝细胞中迅速积累至mM浓度。而口服果糖会导致温和的变化,这可能是由于果糖在肠道内大量代谢所致。尽管葡萄糖和果糖代谢中磷酸化步骤是由不同酶催化,但葡萄糖和果糖的肝脏代谢并不是完全独立的。F1P是KHK介导的果糖磷酸化产物,可有效减轻GCKR(葡萄糖激酶调节蛋白)对GCK(葡萄糖激酶)的抑制作用,使其易位至细胞质并增强肝脏葡萄糖摄取和代谢。因此,果糖的催化量可以显著提高肝脏葡萄糖。F1P 还可以激活丙酮酸激酶(糖酵解最终步骤)并抑制糖原磷酸化酶。通过F1P 介导的调控,膳食果糖可以作为调节肝脏燃料代谢的信号。
第二步,果糖磷酸化后,F1P被醛缩酶 B (ALDOB)代谢为磷酸二羟丙酮 (DHAP)和甘油醛。第三步,甘油醛被三联激酶(TKFC、三激酶和 FMN 环化酶)磷酸化为甘油醛 3-磷酸 (G3P)。DHAP和G3P进入糖酵解/糖异生。尽管细胞和生物体的燃料状态并不调节果糖分解通量,但燃料状态确实影响果糖衍生的磷酸三糖进入中央碳池的命运。例如,在禁食或饥饿的动物中,当PFK活性受到降低的果糖2,6-二磷酸水平限制时,果糖衍生的磷酸丙糖将被用于葡萄糖生产。相反,在喂食动物中,果糖衍生的磷酸丙糖可能优先代谢为丙酮酸并释放为乳酸或用作脂肪生成的底物。与果糖共同摄入的营养素也可能影响其代谢命运。因此,并且摄入果糖对全身燃料稳态的命运和影响取决于系统燃料状态。
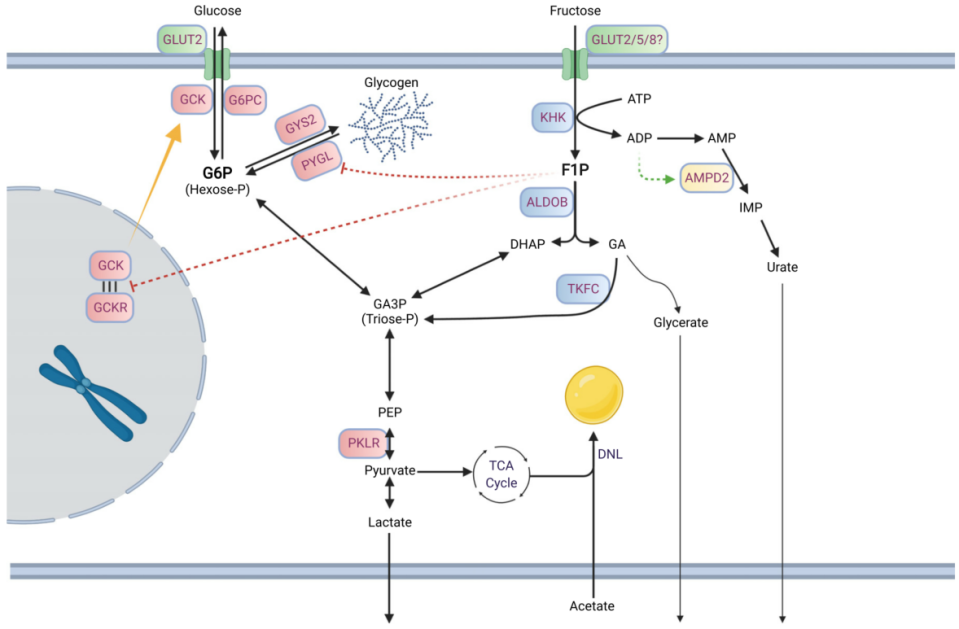
图2. 细胞内果糖代谢
酮己糖激酶
KHK催化果糖磷酸化为F1P是果糖代谢中的关键步骤。人类KHK基因突变引起的功能丧失导致良性原发性果糖尿症。当患有这种疾病的人食用含有果糖的食物时,果糖循环水平会持续升高,如果口服或静脉注射果糖后,尿液中会排出~20%果糖。由于没有已知或报告与KHK活性丧失相关的不良临床后果,患有该疾病的个体未被发现。尽管良性原发性果糖尿患者的循环果糖增加,但血液胰岛素没有增加,也没有糖尿病并发症或%HbA1c增加的报告。KHK整体失活小鼠研究证实KHK介导的果糖代谢对于果糖诱导代谢疾病的重要性。来自同一个基因的KHK编码KHKa和KHKc两种蛋白亚型。果糖与KHKc的Km为~0.5 mM,而果糖与KHKa的Km高出一个数量级以上。KHKa普遍以低水平表达。相反,KHKc在关键代谢组织(包括肝脏、小肠和肾脏)中选择性高水平表达。研究表明KHKc对于果糖诱导的代谢疾病至关重要。KHKc在肠道和肝脏中均表达,肠道KHK敲除会加剧果糖诱导的代谢疾病,而肝脏特异性敲除或敲低KHK可防止果糖诱导的代谢疾病。表明肠道果糖代谢可以保护肝脏免受果糖暴露损害。
其他果糖分解酶
尽管整体KHK功能缺失是良性的,但Aldob功能缺失突变(果糖代谢第二步)会导致遗传性果糖不耐受(HFI),这是一种发病率较高的常染色体隐性孟德尔疾病。患有这种疾病的人可以耐受含有葡萄糖或半乳糖的碳水化合物,而摄入蔗糖或果糖会引发腹痛、恶心和呕吐,并伴有急性低血糖。这种情况在婴儿中通常表现为在断奶或引入含果糖配方奶后发育迟缓并伴有肝毒性,对甜味食物厌恶也很常见。持续接触果糖最终会导致肝肾衰竭,并最终导致死亡。山梨糖醇通过多元醇途径内源性地产生果糖,也会引起类似发病率和死亡率。患有这种疾病的人需要避免所有含果糖饮食,并且通常没有龋齿,表明饮食蔗糖是导致牙齿健康不良的主要原因。消除所有饮食中的蔗糖、果糖和山梨糖醇是治疗的主要手段,在果糖限制数天内可以观察到健康状况改善。
HFI中果糖毒性部分归因于F1P在肝细胞、肠细胞和近端小管上皮细胞中显著的长期累积产生的有害作用。尽管肝、肠和肾中的果糖代谢在HFI中严重受损,但在这些患者尿液中回收的果糖负荷不到20%,表明大部分果糖在其他组织中代谢。在这种情况下,脂肪组织通过己糖激酶II将果糖代谢为6-磷酸果糖可能是果糖代谢的主要方式,良性原发性果糖尿也是如此。HFI的分子生理学已在Aldob全基因敲除小鼠模型中得到证实。通过抑制KHK可以逆转Aldob基因敲除小鼠脂肪变性的增加,进一步支持了F1P是这种疾病发病机制中关键信号分子的假设。以上研究揭示KHK抑制剂可能有助于显著扩大这种疾病患者的食物选择,并保证使用新开发的有效和特异的KHK抑制剂进行试验。
Aldob将 F1P 代谢为DHAP和甘油醛两种代谢物。DHAP无需进一步代谢即可进入糖酵解磷酸三糖池。然而,甘油醛是一种具有反应性和毒性的潜在代谢物,它被Tkfc磷酸化为糖酵解中间体 3-磷酸甘油醛,进而完成果糖分解最后一步。与前两个步骤相比,Tkfc研究较少,部分原因是没有发现临床情况与该酶突变相关。肝脏特异性Tkfc敲除或Tkfc全身敲除小鼠在接受高果糖饮食时表现出肝脏炎症和果糖吸收不良,可能与甘油醛毒性有关。而这些小鼠甘油酸和丝氨酸合成增加,表明甘油醛通过乙醛脱氢酶代谢。最近小鼠研究发现,摄入的大部分果糖以甘油酸的形式从肠细胞输出进入门静脉血,这表明在某些情况下,Tkfc活性可能限制了果糖分解。
绘谱帮你测
与果糖代谢相关的代谢疾病的研究越来越受到关注。靶向代谢组学可对生物样品中小分子代谢物进行全面、系统的分析,可以灵敏捕捉到机体代谢的细微变化,是寻找疾病生物标志物或药物靶标的有力工具。麦特绘谱拥有成熟的代谢物定性和定量平台,开发出Q600全定量代谢组、Q300全定量代谢组、宏代谢组、能量代谢,以及同位素示踪/代谢流等不同的靶向代谢组检测方法,致力于提供代谢组学研究多角度解决方案,详情欢迎咨询麦特绘谱热线400-867-2686。
参考文献
Molecular aspects of fructose metabolism and metabolic disease. Cell Metabolism. 2021. https://doi.org/10.1016/j.cmet.2021.09.010.
原文阅读,请长按识别下方二维码

往期推荐
1. Nature | 果糖摄入通过肠道菌群影响肝脏脂肪生成
4. Nature Reviews Cancer | 肿瘤代谢最全解析
5. Cell Metabolism | 中国代谢研究:现在与未来

