新冠疫情已经在全球范围爆发,目前确诊感染人数已经超过190万,并且这一数值还在持续增长中。在疫情爆发初期,我国科研战线迅速行动,不到一周时间就确定了新冠病毒的全基因组序列并分离得到了病毒毒株,及时向全球共享。那么为什么分离病毒毒株这么重要呢?
毒株分离的意义和难度
病毒毒株的分离对于疫情的防控、抗病毒药物的筛选、疫苗研制等都具有重要意义。首先,分离病毒毒株后,可以得到新冠病毒包括衣壳蛋白、全基因组序列在内的更详细的信息,帮助快速诊断试剂盒的研发,这对于新冠肺炎患者的临床诊断和治疗有非常积极的帮助。其次,得到病毒毒株后,将助力于其致病机理的研究,例如新冠病毒与宿主的结合机制、感染病毒后细胞内的免疫应答等等。最后,病毒毒株的成功分离可以帮助进行抗病毒药物的筛选和疫苗的研发。正如中国工程院李兰娟院士所说,“分离出病毒毒株,意味着我们已经拥有了疫苗的种子株。用其制作疫苗株并通过检测后,就可以制备疫苗”。
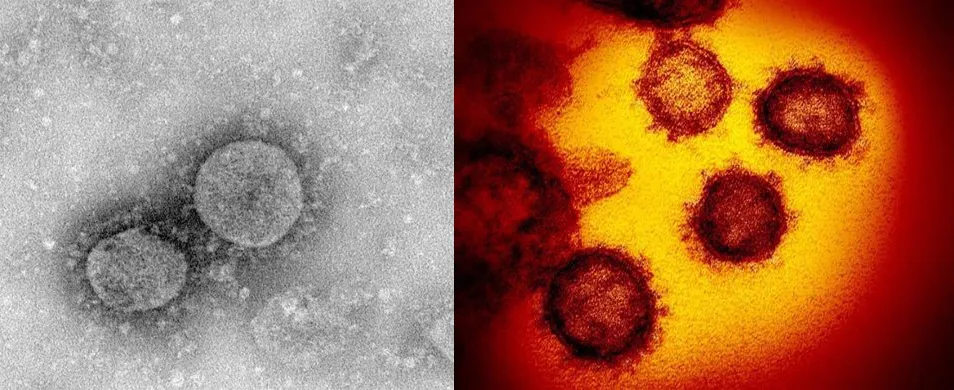
左图1:新冠病毒电镜照片(来自中国微生物组数据中心);右图2:新冠病毒透射显微镜图像(来自NIAID-RML)
然而,虽然目前全国各地新冠研究、药物及疫苗研发如火如荼地开展,但由于新冠病毒株的高传染性与高危险性,毒株始终较难获得,早期研发不易推进。究其原因,首先是培养新冠病毒对实验室要求极高 — 至少须生物安全水平三级 (BSL-3) 实验室;其次实验人员资质、工作流程、污染物的处理都须通过严格的审核,并得到国家卫健委批准。
假病毒及病毒载体揭秘
随着科学家们不断深入地了解和研究,开发表达刺突蛋白(S蛋白)的新冠假病毒成为辅助治疗性筛选的有力工具。截止到目前为止已有多篇基于SARS-CoV-2假病毒中和抗体活性检测的文章发表在国际权威杂志上。假病毒不仅可应用于血清中和抗体检测,还为后续单克隆抗体及抗病毒药物筛选和评价、疫苗研发及病毒感染机制研究等奠定了基础。

图3:由中国医学科学院/北京协和医学院病原生物学研究所的研究团队在国际顶级学术期刊Nature的子刊Nature Communication上发表 ——《Characterization of spike glycoprotein of SARS-CoV-2 on virus entryand its immune cross-reactivity with SARS-CoV》。此项研究构建SARS-CoV-2 S蛋白假病毒系统和293T的hACE2稳转细胞系,以此确定SARS-CoV-2的易感细胞系、病毒受体、侵入途径和蛋白酶激活,揭示了SARS-CoV-2入侵人体细胞的具体过程。
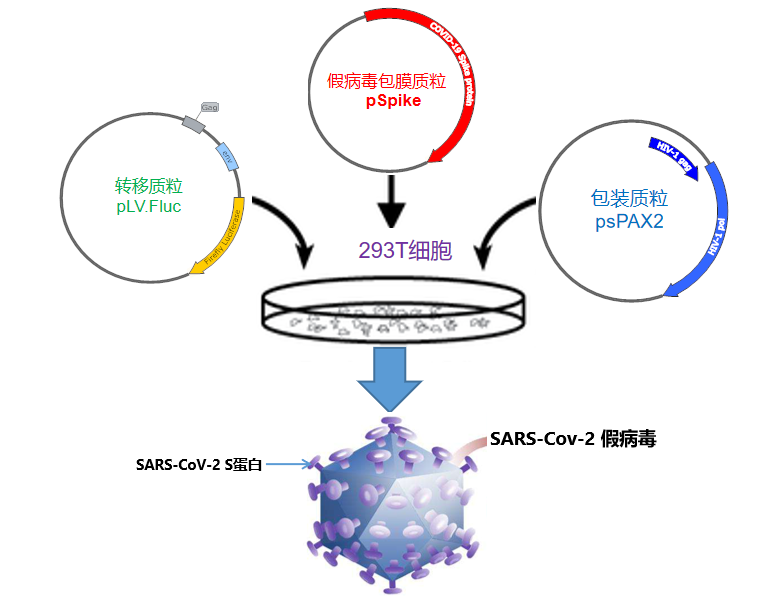
图4:SARS-CoV-2-S假病毒包装过程,图片来源医麦新观察丨《新冠病毒株极难获得,假病毒提供解决方案助力药物开发》
假病毒是依据已公开的序列而制备成一种具有原病毒的基本特点和免疫原性,同时又不具备致病性,方便实验室大规模使用的替代物。由于其生物安全风险较低(仅要求实验室生物安全级别二级(BSL-2)),质控方法可控,可以长期稳定制备和供应。假病毒因其具有“逼真” 、稳定、安全等特点,已被广泛用于研究感染机制,受体识别和病毒抑制,以及开发和评估抗体和疫苗。
假病毒构建通常都依赖于病毒载体系统的重组包装(图5),理想的病毒载体同样也表现出基因组稳定性、细胞型特异性、有效感染率高、对受感染细胞生理机能影响小,同时致病性小等特点。借助病毒载体,例如,慢病毒 (Lentivirus)、水泡性口炎病毒(Vesicular Stomatitis Virus, VSV)、腺病毒 (Adenovirus)、腺相关病毒(Adeno-associated Virus, AAV)将外源基因转导入细胞并构建新的假病毒模型已被广泛应用于生命科学研究,科学家已经探索了出多种用于创建包膜型假病毒的包装系统,用于诸如埃博拉病毒(EBOV),马尔堡病毒(MARV)和拉沙热病毒(LASV)等新兴传染病(EID)的研究。
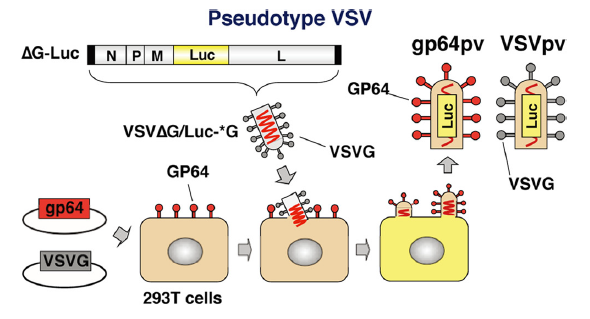
科研人员使用假病毒模拟抗体阻断病毒进入细胞的生物过程,检测抗体或血清对假病毒是否具有中和活性 (假病毒通常经过改造以携带荧光素酶报告基因,使其进行定量分析时比对野生型病毒容易得多,而且已证明假病毒感染的细胞数量与报告基因表达成正比)。图5:假病毒包装过程 - 将荧光素酶和gp64基因插入VSV的全长cDNA克隆中(代替G基因命名为ΔG-Luc)。gp64pv和VSVpv是通过将VSVΔG / Luc-* G分别瞬时感染表达GP64和VSVG的293T细胞而产生的。
由于病毒与假病毒颗粒较小,直径基本在20-300纳米之间 (新冠病毒电镜照片显示其直径仅为100纳米),低转速、低离心力条件并不能使病毒颗粒充分沉降,须借助超速离心技术来进行病毒颗粒分离。
而病毒载体的分离方式与病毒类似—当携带目的基因的病毒载体感染培养的细胞,受感染细胞生产新的同类病毒,并释放进入培养基中,再将新病毒重新采集并纯化。在此过程中产生的病毒载量、纯度和质量都会直接影响后续载体的转导效率。高效可靠的离心方案同样有助于优化病毒载体纯化,例如:在高速和超速离心条件下,能有效地将病毒颗粒从细胞、细胞碎片中精细分离;借助分析性超速离心(AUC) 的流体动力学和热力学全方位精准测量,则可根据病毒衣壳密度(一种病毒载量衡量方式),来真实鉴定区分完整、含部分遗传物质、空壳病毒载体及其他细胞杂质,提高包装效率,提供药用级别病毒载体颗粒质控 。
您可以通过以下视频了解病毒纯化流程
想了解详细的病毒和假病毒分离方法及步骤,请关注下期内容《如何高效分离新冠病毒毒株与假病毒》,小贝将具体解析超离纯化病毒的实验方法,敬请期待!
干货来啦!!!!
点击文末的“阅读原文”即可免费获取“病毒及病毒载体分离纯化文献检索列表”
![]()
自1947年第一台商用超速离心机发明以来,贝克曼库尔特离心技术已有70多年的发展历史。早在19世纪60年代,已有科学家使用贝克曼离心机成功分离了多种病毒颗粒。到今天,贝克曼超速离心技术已助力科学家们分离得到冠状病毒、流感病毒、肝炎病毒、腺病毒、慢病毒等几乎所有类型的病毒种类。
贝克曼庞大的用户群体已发表了数以万计的病毒分离方法,为研究人员储存了大量文献支持,在助力病毒研究的同时,也使贝克曼离心机成为了当之无愧的病毒分离专家!

参考文献
1. Xiuyuan Ou et al. Characterization of spike glycoprotein of SARS-CoV-2 on virus entry and its immune cross-reactivity with SARS-CoV. Nat Commun. 2020 Mar 27;11(1):1620.
2. Yuuki Kaname et al. Acquisition of Complement Resistance through Incorporation of CD55/Decay-Accelerating Factor into Viral Particles Bearing Baculovirus GP64. JOURNAL OF VIROLOGY, Apr. 2010, p. 3210–3219 Vol. 84, No. 7
3. Qianqian Li et al. Current status on the development of pseudoviruses for enveloped viruses. Reviews in Medical Virology : Vol 28 , No 1

请点击“阅读原文”获取“病毒及病毒载体分离纯化文献检索列表”~