代谢功能障碍相关的脂肪肝病(metabolic dysfunction-associated steatotic liver disease, MASLD,旧称非酒精性脂肪性肝病NAFLD)影响着全球三分之一的人口,它的特征是可逆的肝脂肪变性。代谢变化是MASLD发展和恶化的关键,其中氨基酸代谢已成为其发病机制的一个新特征。有研究表明,较低的循环甘氨酸水平与MASLD、心脏代谢疾病和代谢综合征有关,但关于MASLD中甘氨酸水平下降的机制仍不明朗。
近期,以色列理工学院Eyal Gottlieb,Inbal Mor和美国路易斯安那州立大学健康科学中心Oren Rom共同合作,在Cell Metabolism上发表题为“Serine synthesis via reversed SHMT2 activity drives glycine depletion and acetaminophen hepatotoxicity in MASLD”的研究文章。该研究通过非靶向代谢组、稳定同位素示踪(代谢流)等技术手段,揭示了MASLD肝脏中甘氨酸减少的根本原因及这一过程如何影响肝脏的解毒能力,并发现补充甘氨酸等治疗可缓解这种不良影响。本研究为临床MASLD的用药安全监测及新疗法的开发提供了见解与策略。

技术路线
CD组:标准食物饮食10周的小鼠
WD组:西方饮食(高脂高糖)10周的小鼠
APAP:对乙酰氨基酚
研究结果
1. MASLD中发生一碳代谢缺陷,甘氨酸消耗
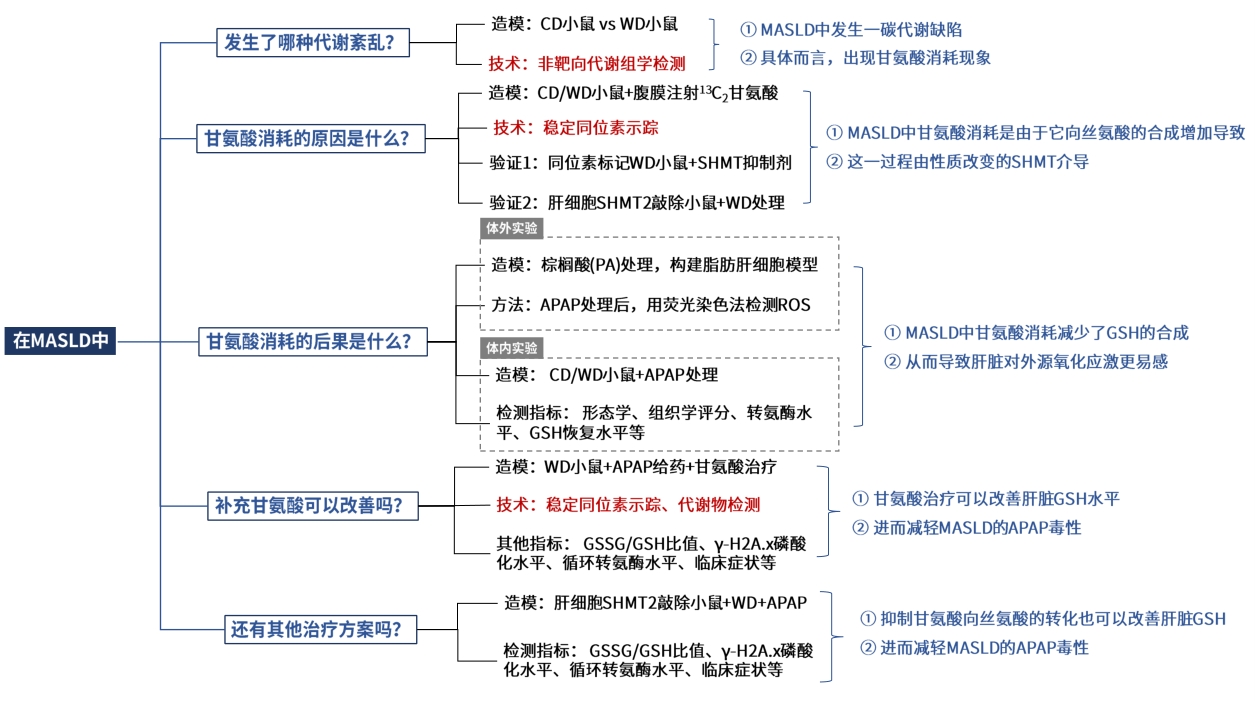
为研究MASLD初期阶段的潜在代谢变化,作者对WD组和CD组小鼠进行了表型和和生理生化分析,确定WD组小鼠呈现MASLD初期症状,然后对两组小鼠的肝脏和血浆样本进行了非靶向代谢组学检测,从小鼠肝脏中鉴定出324种化合物,从血浆中鉴定出260种化合物;与CD组相比,WD组小鼠的肝脏差异代谢物有107种,血浆差异代谢物有88种;对这些差异物质进行通路富集分析显示,“丝氨酸与甘氨酸代谢”及“甲基化循环(甲硫氨酸和甜菜碱代谢)” 是最显著富集的通路。
肝脏是一碳代谢的主要器官,丝氨酸羟甲基转移酶(SHMT)可介导丝氨酸和甘氨酸相互转化,同时发生四氢叶酸甲基的转移;此外甘氨酸还作为甘氨酸N-甲基转移酶(GNMT)的甲基受体,产生单甲基甘氨酸(肌氨酸)。与对照CD组相比,WD小鼠的甘氨酸、肌氨酸含量均显著降低,此外大多数甘氨酸衍生物如谷胱甘肽等含量持续减少,但相比之下,肝脏丝氨酸水平没有下降,而血浆丝氨酸水平显著升高,导致WD小鼠的丝氨酸与甘氨酸之比增加。
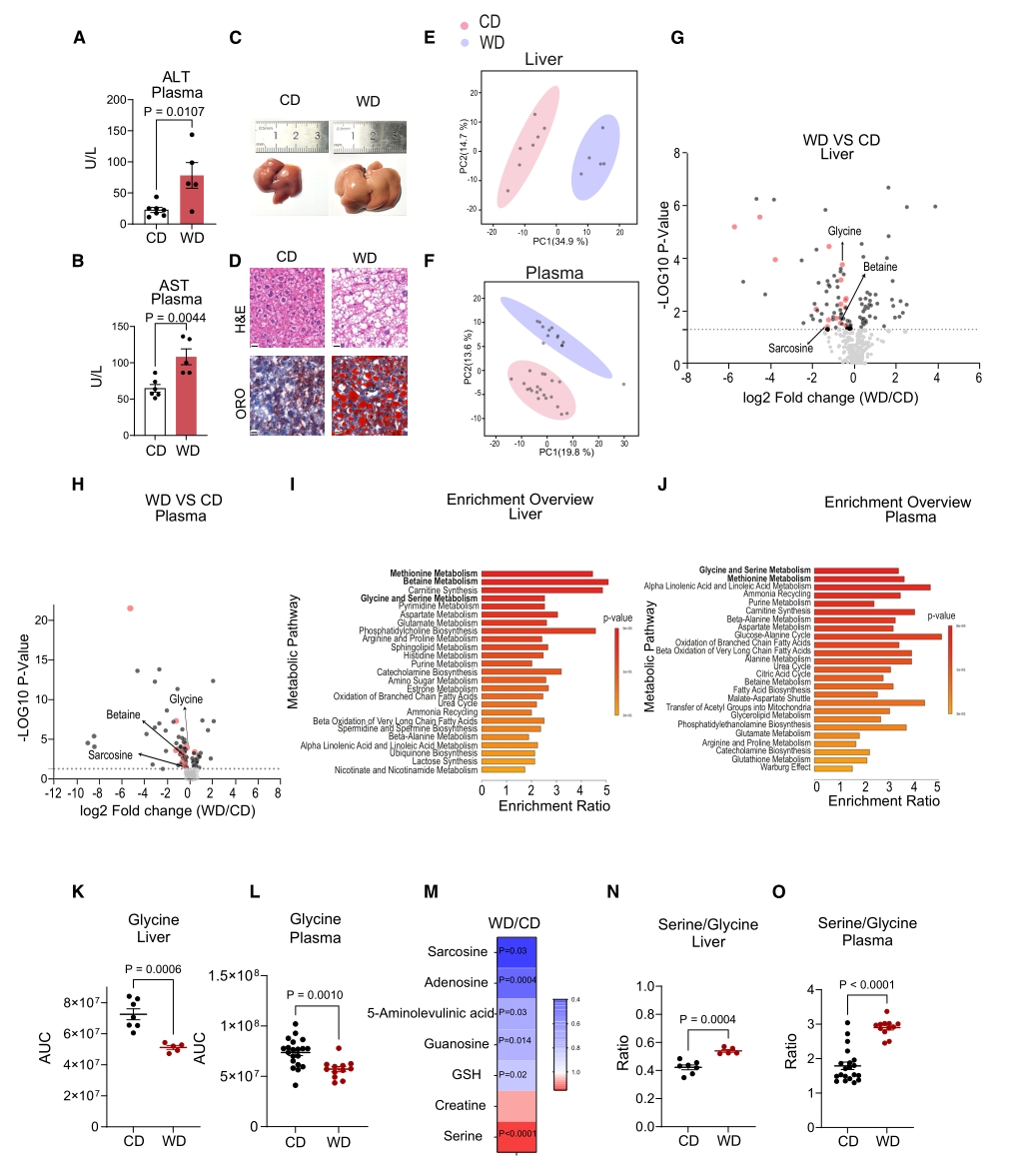
图1. 代谢组学显示肝脂肪变性小鼠的一碳代谢下调
以上结果表明,MASLD中发生了甘氨酸消耗现象,其原因可能是SHMT介导的丝氨酸合成增加。
2. 肝脂肪变性的甘氨酸消耗是由丝氨酸合成增加引起的
为验证上文提出的MASLD甘氨酸消耗假设,作者使用了稳定同位素标记13C2的甘氨酸对CD和WD组小鼠进行同位素示踪分析。结果表明,13C2甘氨酸处理后,CD和WD小鼠的血浆甘氨酸含量均升高,肝脏甘氨酸也升高,但WD组低于CD组;肝脏中的丝氨酸标记模式表明相当一部分丝氨酸是由甘氨酸合成的;此外,血浆中的丝氨酸水平和标记模式表明,WD小鼠体内由甘氨酸合成丝氨酸的速率更高。
接下来作者进行了两项验证实验。首先,在上述13C2甘氨酸标记的基础上,使用广谱SHMT抑制剂——SHIN1处理WD组小鼠,发现肝脏和血浆中丝氨酸水平显著降低,而甘氨酸含量显著增加,证明了MASLD中的甘氨酸减少是由肝脏中SHMT介导丝氨酸合成增加导致的。随后构建了肝细胞SHMT2敲除的模型小鼠,并进行WD处理,结果表明,与非敲除组相比,SHMT2敲除小鼠的循环甘氨酸水平显著增加,证实了MASLD中甘氨酸的减少是肝细胞代谢变化的直接结果,并确定了线粒体SHMT2参与其中。

图2. 肝脂肪变性小鼠的甘氨酸消耗是由丝氨酸合成增加导致
3. 甘氨酸的缺失增加了MALSD对外源性氧化应激的易感性
谷胱甘肽(GSH)是一种由甘氨酸和谷氨酸及半胱氨酸组成的三肽,在肝脏应对氧化应激及解毒过程中发挥着重要作用。因此甘氨酸消耗会导致GSH合成减少,在前述的代谢组学分析结果也发现了WD小鼠GSH含量减少的现象。
为进一步研究脂质积累、甘氨酸缺失与肝脏氧化应激的关系,作者分别用棕榈酸PA及油酸OA处理AML12细胞系,构建了两种脂肪肝细胞模型。进一步的研究发现PA处理显著降低了肝细胞内的甘氨酸和GSH水平,并导致氧化应激增加。对乙酰氨基酚(APAP)是一种解热镇痛药物,过量将造成肝毒性,它的安全代谢需要GSH的参与。PA+APAP的共同使用加重了肝细胞的氧化应激,而补充甘氨酸或GSH均可缓解这种氧化应激。
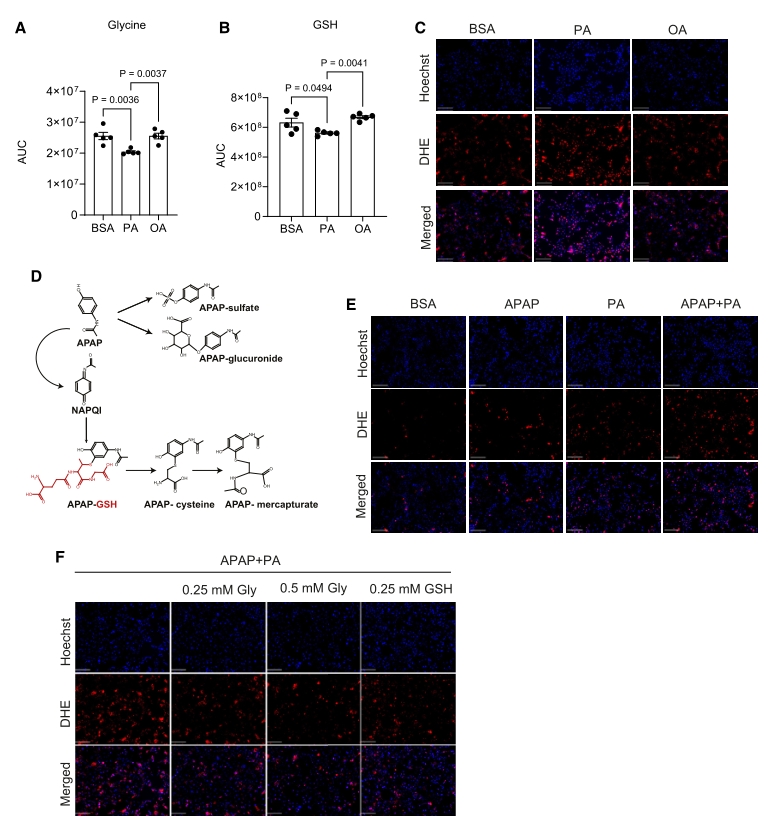
图3. PA处理会降低培养肝细胞内的甘氨酸和GSH水平,并增加对APAP的敏感性
随后作者在小鼠体内进行验证实验。结果显示,给予APAP处理后,相比CD组,WD小鼠的肝毒性及氧化应激增强,体现在循环转氨酶水平、肝脏形态学、组织学评分等指标,这与体外细胞实验的结果一致。

图4. 肝脂肪变性的小鼠GSH减少、氧化应激和肝毒性增加
以上结果显示,肝脂肪变性增加了肝脏对外源性氧化应激的易感性。
4. 甘氨酸可改善肝脏GSH水平,减轻MASLD的APAP毒性
接下来作者探索甘氨酸治疗是否可以减轻MASLD的APAP毒性。具体而言,对于WD小鼠,在APAP给药后的两个时间点给予甘氨酸治疗,随后进行各项指标检测。结果表明,口服甘氨酸提高了肝脏GSH的水平,且同位素标记示踪显示这些GSH中有相当一部分来自补充的甘氨酸。此外,补充甘氨酸也减轻了APAP诱导的氧化应激、脂质过氧化和DNA损伤,表现在GSSG/GSH比值、γ-H2A.x磷酸化水平、循环转氨酶水平、临床症状等指标。
图5. 甘氨酸可恢复肝脂肪变性小鼠的GSH水平并减轻APAP肝毒性
以上结果表明,甘氨酸治疗可以改善MASLD中APAP肝毒性增强的情况。
5. 敲除SHMT2可恢复MASLD的谷氨酸和GSH水平,减轻APAP肝毒性
考虑到MASLD中的甘氨酸消耗是由于肝细胞中SHMT2介导的丝氨酸合成增强导致的,作者下一步拟确定肝细胞中SHMT2的缺失是否能减轻APAP的肝毒性。因此作者对肝细胞SHMT2敲除的模型小鼠进行WD+APAP给药处理,结果显示,与对照组相比,敲除组小鼠的肝脏甘氨酸和GSH水平显著升高,氧化应激、DNA损伤程度及循环ALT水平显著降低,临床症状也有所改善。

图6. 肝细胞特异性的SHMT2缺失可缓解肝脂肪变性小鼠的APAP毒性
以上结果表明,阻断肝细胞中的SHMT2可以提高甘氨酸含量,进一步促进GSH的合成,从而减轻MASLD中的APAP肝毒性。
研究结论
本研究通过非靶向代谢组、稳定同位素示踪(代谢流)等研究方法,发现在MASLD中,丝氨酸羟甲基转移酶2(SHMT2)的活性改变,增强了甘氨酸向丝氨酸的转化,使得肝脏GSH的含量降低,抗氧化应激能力减弱,最终降低了肝脏对潜在肝毒性药物(如APAP)的耐受性。此外,通过补充甘氨酸或抑制甘氨酸向丝氨酸的转化可以减轻MASLD的APAP肝毒性。

参考文献
Ghrayeb A, Finney AC, Agranovich B, et al. Serine synthesis via reversed SHMT2 activity drives glycine depletion and acetaminophen hepatotoxicity in MASLD. Cell Metab. 2024 Jan 2;36(1):116-129.
请扫描二维码阅读原文

绘谱帮你测
上述研究中的氨基酸靶向检测和代谢流技术本均为本公司经典技术产品,已协助客户发表以CNS主刊和子刊为代表的多篇高水平成果(详询技术经理)。
麦特绘谱开创性地搭建了医学领域高端代谢组学技术平台,覆盖了非靶向-全定量-代谢流等全方位的高端医学代谢组解决方案,同时全面布局微生物组学、转录组学和蛋白质组学等多组学技术服务,已成为全球多组学研究者的优选合作伙伴。麦特绘谱拥有Q1000、Q500、Q300、Q200和胆汁酸等各类小分子代谢物、非靶向代谢组学和同位素示踪代谢流技术等共40+系列检测方法;已为数百家三甲医院、科研院所和企业提供多组学解决方案,协助客户与合作伙伴发表SCI文章400+篇,累计影响因子4000+,平均IF>10,包括Science, Nature, Cell Metabolism, Immunity, Gut, Hepatology, Microbiome等顶级期刊。
END
