非编码RNA在许多肿瘤发生发展的各阶段的起到重要作用,是目前肿瘤研究的热点。非编码RNA几乎参与了肿瘤细胞的增殖、分化、转移。此外,非编码RNA作为疾病标志物不断被发现,正成为研究人员寻找相关肿瘤治疗的靶标。
长链非编码RNA(lncRNA)是一类非编码RNA,其长度在200nt以上,在肿瘤的发生发展中具有多种作用,它以ceRNA方式作为海绵吸附miRNA从而调控相关基因的表达,也可以协同转录因子激活相关基因的表达或者结合蛋白防止蛋白降解从而促进蛋白相关功能的发挥。lncRNA的ceRNA网络研究目前已经较为普遍,这里我们将借助一篇文献,主要从lncRNA与多种蛋白及核酸互作的角度来介绍lncRNA的功能、机制研究。
1. 通过模型和临床标本寻找要研究的lncRNA—H19
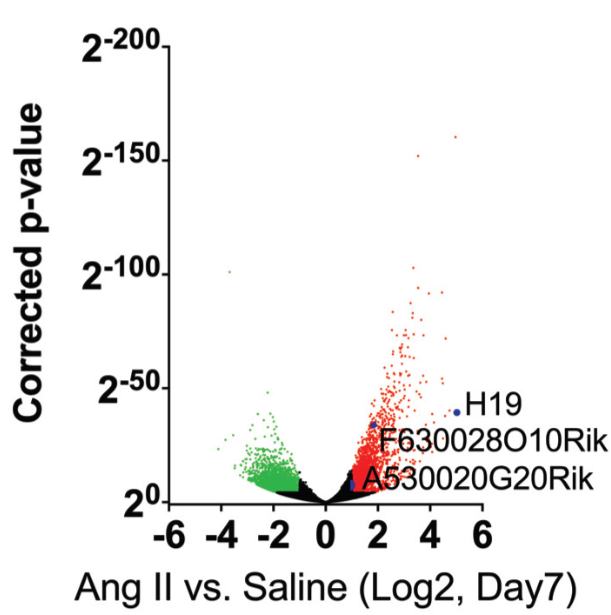
基于前期miRNA与腹部动脉瘤的相关研究结果,作者欲从长链非编码入手探究其与腹部动脉发生发展关系。作者首先建立了鼠腹动脉瘤模型和迷你猪动脉瘤模型,运用lncRNA测序研究了腹部动脉瘤鼠模型、人体组织标本中稳定未破的和破裂的瘤体组织lncRNA的表达谱综合交错分析,发现H19是在两种模型和人体组织中上调差异最明显的lncRNA。
图1 AngⅡ诱导后七天检测的受异常调控的转录本的火山图
2. 原位杂交、细胞增殖、凋亡及基因敲减验证H19的定位及功能特性
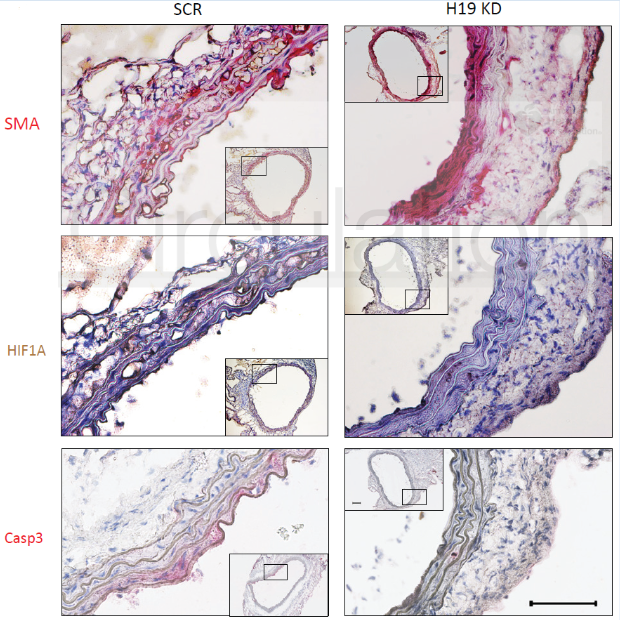
原位杂交显示,H19主要在无病组织的中层平滑肌细胞(SMC)和外膜成纤维细胞中表达,血管紧张素II(AngII)刺激后H19在中层血管平滑肌细胞中表达增加,说明H19通过影响血管平滑肌细胞的动力学参与腹动脉瘤发生发展。
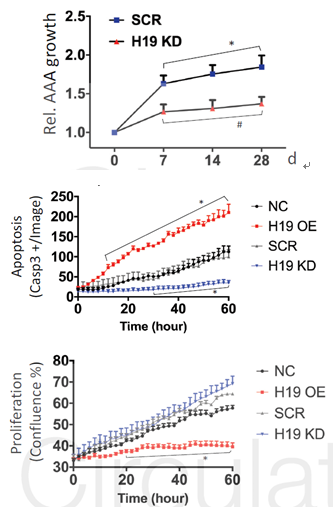
细胞增殖实验显示AngII可以促进SMC细胞的凋亡,降低细胞的增殖速率,同时,AngII可以提高H19的表达,H19的敲减可以抑制AngII的功能作用。对H19做进一步研究发现,过表达H19可以促进SMC细胞的凋亡,而敲减H19可以抑制细胞的凋亡,但是H19的表达变化对细胞的增殖没有影响。
图2 H19敲低和过表达对腹动脉瘤和血管平滑肌细胞生长、增殖和凋亡的影响
3. H19不是通过miR-675的剪切表达调控SMC细胞的功能
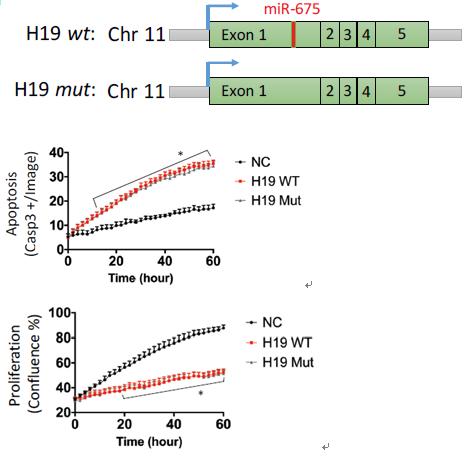
miR-675在H19的第一个外显子上,前期研究表明H19可以剪切表达miR-675,通过miR-675发挥调控作用。这里作者对H19是否通过miR-675发挥作用进行了研究,通过构建缺失miR-675表达载体,与野生型共转染到SMC细胞中,野生型和缺失突变型均诱导了细胞的凋亡。同时,在组织样本和AngII诱导的腹动脉瘤模型中均未检测到miR-675的显著差异表达。说明H19不是通过miR-675来调控SMC的凋亡的。
图3 miR-675缺失突变型和野生型的H19均诱导细胞凋亡抑制细胞增殖
4. H19调控SMC表达的途径
作者接着从转录因子入手,通过生信分析,筛选出了几个可以和H19互作的转录因子,分别为CREB1(cAMP responsive element binding protein 1)、TFCP2(transcription factor CP2)、GTF2IRD1(GTF2I repeat domain containing 1)、SMAD4(SMAD family member 4)、HIF1α、ZBTB14(zinc finger and BTB domain containing 14)、KLF11(Krüppel-like factor 11)、TFAP2α(transcription factor AP-2 alpha)。作者接着在SMC中过表达、敲低H19,用定制的RNA表达芯片检测上述转录因子的表达,发现过表达H19可以促进HIF1α的表达,抑制H19可以抑制HIF1α的表达,HIF1α是唯一受调控的转录因子。
图4 q-PCR检测过表达和敲低H19后相关转录因子的表达
如何证明是HIF1α调节H19在SMC中的发挥功能作用的呢?SMC细胞中干扰HIF1α后,HIF1α的mRNA和蛋白表达量均显著下调,同时,促凋亡蛋白BAX也与HIF1α的表达一致,BCL-2的表达量则相反,但是H19的表达量没有改变。相反,H19的过表达可以显著提高HIF1α的表达。这些结果暗示了H19可能通过HIF1α来调控细胞的凋亡。
图5 q-PCR检测过表达和敲低HIF1α后凋亡相关分子的表达
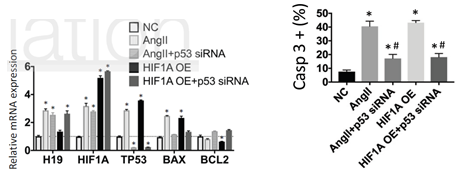
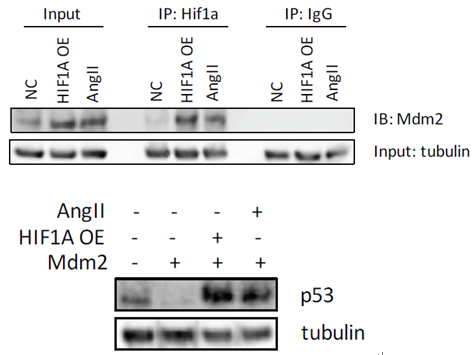
由于BAX是受P53调控,因此P53可能参与H19促凋亡。通过敲低P53的表达,发现P53的敲低可以显著抑制HIF1α过表达或者AngII促进的SMC细胞凋亡,这说明P53参与了H19-HIF1α诱导的凋亡。有报道,肺癌和鼠胚胎成纤维细胞中P53是受E3泛素连接酶Mdm2(mouse 3T3 cell double minute 2)的调控。作者接着通过Co-IP及相关刺激因子诱导实验,证实了HIF1α可以和Mdm2结合从而降低P53的泛素化,促进SMC细胞的凋亡。
图6 CO-IP实验证实HIF1α可以与Mdm2结合
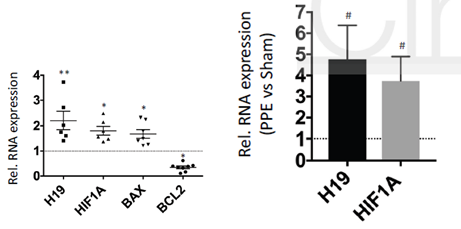
H19、HIF1α、BAX、BCL2在人类疾病样本和两种鼠模型中的表达模式与上述细胞系研究中的结果相符,进一步地验证了上述的结论。
图7 H19、HIF1α、BAX、BCL2在疾病样本和鼠模型中的表达
5. H19与HIF1α在胞质中的共定位及互作
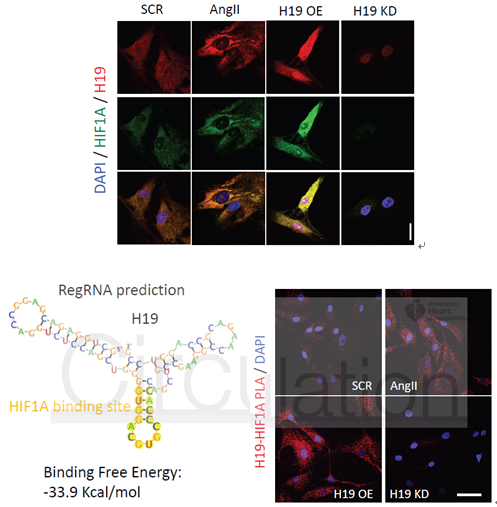
H19有无可能直接与HIF1α互作呢?生物信息学分析显示H19上有结合HIF1α的二级结构,作者接着采用了原位杂交、邻位连接(PLA)技术证实了H19与HIF1α在胞质中的共定位及互作(<40nm)。
图8 原位杂交、邻位连接(PLA)技术证实H19与HIF1α在胞质中的共定位及互作
6. 细胞核中的H19通过与SP1及HIF1α启动子结合促进HIF1α的转录
前面研究已经发现H19可以促进HIF1α的表达,那么能在细胞质中与HIF1α结合的H19能直接在细胞核中发挥调控HIF1α的作用吗?
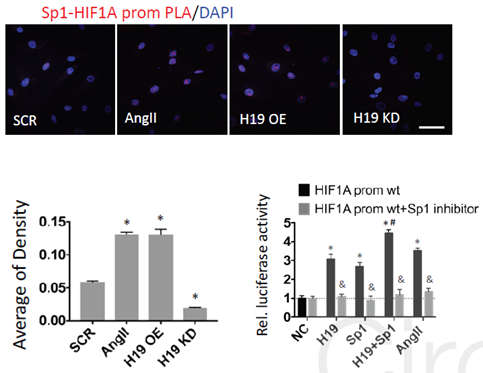
已有研究发现HIF1α的转录依赖于转录因子特异蛋白1(Sp1),HIF1α启动子区域有几个与Sp1结合的位点,H19有可能通过影响Sp1的结合促进HIF1α的转录。作者接着运用ISH、PLA、萤光素酶及Sp1抑制等实验证实了H19可以招募Sp1从而促进HIF1α的转录。
图9 PLA、萤光素酶及Sp1抑制实验
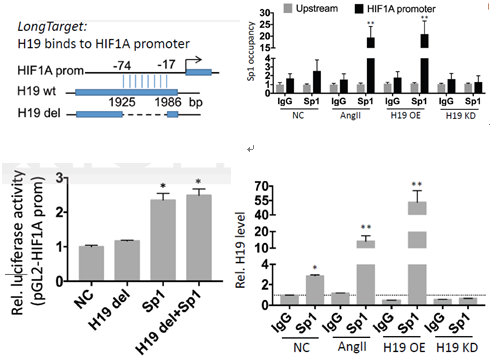
另一方面,通过LongTarget tool预测,H19上存在与HIF1α启动子区结合的区域。通过去除H19相应区域,H19仍然保留它的促进细胞凋亡的作用,但是丧失促HIF1α转录的作用。最后,作者通过RNA-ChIP实验进一步证实了Sp1及H19可以与HIF1α的启动子区结合。
图10 RNA-ChIP、敲除实验进一步证实H19通过招募Sp1促进HIF1α的转录
总结
同其他文章相比,本文的特色是通过生物信息学、分子互作技术对H19促进SMC细胞凋亡的功能作了研究。在细胞质中,H19通过与HIF1α结合招募Mdm2降低P53的泛素化,从而促进SMC细胞的凋亡,促进腹动脉瘤的进展;在细胞核中,H19通过与HIF1α启动子区结合,同时招募Sp1到启动子区,从而促进HIF1α的转录,促进SMC细胞的凋亡,最后促进腹动脉瘤的进展。本文对H19的功能作了一个详实而全面的研究,为研究疾病相关的长链非编码RNA提供了一定的思路。
如何低成本研究空间转录组?看完这篇文章你或许会有答案
(2022-06-02T14:51 浏览数:5832)
【周二晚八点】从位置到功能--空间转录组应用
(2022-05-16T08:59 浏览数:6634)
Cell Reports:利用空间转录组解析哺乳动物精子生成
(2022-04-28T14:54 浏览数:7835)
RNA二级结构调控基因表达的研究现状和进展
(2022-04-21T13:39 浏览数:5736)
Nature: MERFISH绘制小鼠初级运动皮层空间细胞图谱
(2022-04-18T13:24 浏览数:4564)
大自然的恩赐-外泌体药载
(2022-04-08T13:43 浏览数:6058)
【详解】基于图像的单细胞空间分辨转录组学技术
(2022-04-01T11:18 浏览数:10057)
知无不“研”,五分钟带你了解空间分辨转录组学的前世今生
(2022-03-18T14:00 浏览数:6866)
唾液外泌体与临床疾病的关联研究
(2022-03-11T16:36 浏览数:5322)
唾液外泌体与临床疾病的关联研究
(2022-03-11T16:36 浏览数:5854)