头颈部肿瘤(Head and Neck Cancer)主要包括口腔癌、鼻咽癌、口咽癌、喉癌和下咽癌等,是世界第7大肿瘤。IARC最/新统计数据指出,2020年全球新发878,348例,死亡444,347例。
本期吉凯基因应相关研究者的要求,整理了近两年来基于蛋白质组学进行头颈部肿瘤研究的研究案例,供研究者设计实验方案参考,备战国自然。由于头颈部肿瘤中的口腔癌和鼻咽癌发病率相对较低,且受无法利用原位肿瘤动物移植模型以及原发肿瘤动物模型进行研究影响,关于这两类肿瘤研究的文献数量也相对较少,但在我们搜索到的有限的基础研究的文献中,不乏高水平蛋白质组学研究。蛋白质组学作为高效的高通量筛选技术,在这两个肿瘤的基础研究中,主要用于广泛地表征疾病特征、分析差异蛋白、发现疾病靶标和生物标志物等。如果想获取文献原文,请联系吉凯客服(微信号: jikaikefu)哦~~
特点:基于临床样本和病理信息,以组学数据为核心结果,无细胞/动物水平上的功能验证实验。
案例一
Proteomic Alterations Associated with Oral Cancer Patients with Tobacco Using Habits
不同烟草使用习惯的口腔癌患者的蛋白质组变化
期刊:OMICS-A JOURNAL OF INTEGRATIVE BIOLOGY
影响因子:3.987
单位:印度生物信息研究所
发表时间:2022年
研究思路概述:
1. 口腔癌组织和癌旁组织蛋白质组学
(1)咀嚼烟草的口腔癌患者4人
(2)抽烟的口腔癌患者4人
(3)无烟草和酒精使用的口腔癌患者4人
2. 差异蛋白比较
(1)咀嚼烟草的癌组织vs. 癌旁组织
(2)抽烟的癌组织vs. 癌旁组织
(3)无烟草和酒精使用的癌组织vs. 癌旁组织
3. 差异蛋白的功能和通路分析
研究结果:
研究者对不同烟草使用习惯的口腔癌患者的癌组织和癌旁组织进行了蛋白质组学检测和比较分析。吸烟的口腔癌患者的癌组织中存在胶原形成和抗原加工/提呈途径的失调。咀嚼烟草的口腔癌患者癌和癌旁组织相比的差异蛋白富集在角质化相关通路。此外,在三个队列中均发现了参与免疫途径的蛋白质过表达以及肌肉收缩信号事件的下调。总体,本研究分析了不同烟草暴露情况下口腔癌患者癌组织与癌旁组织的差异蛋白,将帮助我们从不同烟草使用习惯的人群中识别口腔癌发展的高风险患者。
案例二
Novel Plasma Proteomic Biomarkers for Early Identification of Induction Chemotherapy Beneficiaries in Locoregionally Advanced Nasopharyngeal Carcinoma
血浆蛋白质组学鉴定局地晚期鼻咽癌(LA-NPC)诱导化疗的早期受益蛋白标志物
期刊:Frontiers in Oncology
影响因子:5.738
单位:汕头大学医学院粤北人民医院
发表时间:2022
研究路线概述:
1. 血浆DIA蛋白质组学(血浆进行去高丰度蛋白处理)
(1)诱导化疗治理前(64)
(2)诱导化疗治疗后(64,其中34个治疗有效EFF和34个治疗无效NEFF)
(3)健康个体(50)
2. 差异蛋白分析
(1)局地晚期鼻咽癌vs.健康个体
(2)治疗有效患者治疗前vs.治疗无效患者治疗前
(3)治疗有效患者治疗前vs.治疗有效患者治疗后
(4)治疗有效患者治疗后vs.治疗无效患者治疗后
3. 差异蛋白功能分析;
4. 治疗前血浆蛋白与临床特征的关联;
5. 治疗前血浆蛋白与诱导化疗受益的关联;
6.分析诱导化疗受益的预测性生物标志物。
研究结果:
与健康个体相比,在患者血浆中发现1027个差异表达蛋白(DEP)。治疗前的血浆蛋白中,治疗有效和治疗无效组间有463个DEP。治疗有效的患者在治疗前后有1212个DEP。治疗后的血浆蛋白质组学相比,治疗有效和治疗无效组间有276个DEP。WCCNA分析鉴定了与临床特征相关的9种蛋白质共表达模块。差异蛋白的功能富集分析表明,这些差异蛋白可以通过免疫、补体途径、凝血、氨基葡萄糖和丝氨酸途径发挥作用。有4个蛋白质在所有组比较中都差异表达,它们分别是PON1、IGFBP-3、v-kappa-3和DDX55,且与临床特征或临床益处有关。这4个蛋白质构成的组合模型在诊断LA-NPC、确定潜在诱导化疗(IC)受益者、评估IC治疗响应和区分IC治疗有效与否的ROC AUC分别为0.92、0.95、0.97和0.94,呈现出了良好的蛋白标志物作用。
特点:基于肿瘤细胞,以组学为切入口找新基因,在细胞/动物水平上进行功能验证实验。
案例一
CRISPR/Cas9 genome-wide screening identifies LUC7L2 that promotes radioresistance via autophagy in nasopharyngeal carcinoma cells
LUC7L2通过自噬促进鼻咽癌(NPC)细胞的放射抗性
期刊:Cell Death Discovery
影响因子:7.109
单位:中南大学湘雅医院
发表时间:2021
研究路线概述:
1. 接受人全基因CRISPR敲除库的NPC放射抗性细胞系 CNE2IR培养后分别接受或不接受电离辐射(IR)处理。与IR处理组相比,无IR组中有10个基因表现出显著变化的拷贝数改变;
2. 基于蛋白质组学(放射抗性CNE2IR vs.原癌细胞CNE2)分析上述提到的10个基因是否有蛋白表达的改变,锁定蛋白上调倍数最大的LUC7L2作为后续研究对象;
3. 验证CNE2IR 中LUC7L2的表达;
4. 分别在CNE2细胞中过表达LUC7L2、在IR抗性细胞系中敲低LUC7L2,检测IR处理下细胞的生存情况;
5. 分析LUC7L2与鼻咽癌患者生存之间的关系;
6. CO-IP 检测LUC7L2 与一个自噬相关蛋白SQSTM1结合;
7. 检测干扰LUC7L2后NPC放射抗性细胞系CNE2IR的自噬流变化;
8. 检测干扰LUC7L2后NPC放射抗性细胞系CNE2IR在自噬抑制剂处理情况下细胞生存的变化。
研究结果:
在本研究中,作者首先通过CRISPR/Cas9敲除库的高通量筛选和定量蛋白质组学方法鉴定了一个候选的辐射抗性相关基因LUC7L2。在鼻咽癌细胞中过表达LUC7L2可促进电离辐射(IR)后的细胞活力,而敲除LUC7L2显著减慢DNA复制和损害细胞生存,使鼻咽癌耐辐射细胞对IR敏感。机制上,作者发现自噬受体SQSTM1是LUC7L2的潜在结合蛋白。在鼻咽癌抗辐射细胞中下调LUC7L2可导致SQSTM1表达减少、自噬水平增强。此外,自噬抑制剂氯喹(CQ)抑制LUC7L2,导致更多的鼻咽癌耐辐射细胞死亡。结合临床信息,作者发现LUC7L2明显分布于鼻咽癌组织中,高表达的LUC7L2与鼻咽癌患者的较短生存期相关。总体,作者的数据表明,LUC7L2在鼻咽癌细胞的放射抗性调节中起着重要作用,并有望成为鼻咽癌放疗再敏感的治疗靶点。
案例二
RRBP1 rewires cisplatin resistance in oral squamous cell carcinoma by regulating Hippo pathway
RRBP1通过调控Hippo途径介导口腔鳞状细胞癌的顺铂抗性。
期刊:British Journal of Cancer
影响因子:9.075
单位:印度生命科学研究所
发表时间:2021年
研究思路概述:
1. 构建顺铂抗性的口腔鳞状细胞癌(OSCC)细胞;
2. 蛋白质组学和转录组RNA测序检测顺铂抗性细胞中的失调蛋白/基因:
(1)蛋白质组学样本分组:H357CisS(顺铂敏感,n=2)vs. H357CisR4M(顺铂抗性早期,n=3) vs. H357CisR8M(顺铂抗性后期,n=3);
(2)转录组RNA测序样本分组:H357CisS(顺铂敏感,n=2)vs. H357CisR4M(顺铂抗性早期,n=2)vs. H357CisR8M(顺铂抗性后期,n=2)。
3. 差异蛋白/基因分析及比较:找到一个在两个组学的顺铂抗性细胞中均上调的基因RRBP1;
4. 验证RRBP1表达水平:检测顺铂抗性细胞、顺铂治疗响应者和未响应者组织中的RRBP1的表达;
5. 验证RRBP1功能:在顺铂抗性的癌细胞中敲低RRBP1检测癌细胞的顺铂耐药性;
6. RRBP1在顺铂耐药细胞中的调控机制分析:
(1)IPA分析发现顺铂耐药细胞存在Hippo信号通路的高度下调
(2)转录组RNA测序检测干扰RRBP1的顺铂耐药癌细胞中的基因变化
(3)两套转录组RNA测序结果比较发现在顺铂敏感癌细胞和RRBP1敲除的顺铂抗性癌细胞中Hippo信号通路中的YAP1蛋白靶基因CCN1和CCN2均下调
(4)检测顺铂抗性癌细胞中RRBP1对YAP1的调控
7. 验证RRBP1药靶可能性:
(1)检测RRBP1抑制剂是否可以恢复顺铂诱导的顺铂抗性OSCC细胞的死亡
(2)检测RRBP1敲除对化疗抗性PDX模型中细胞凋亡的影响
研究结果:
研究者通过分析顺铂抗性和敏感的口腔鳞状细胞癌(OSCC)细胞的蛋白质组和转录组变化,锁定RRBP1是在顺铂耐药早期和后期高表达的基因。与化疗响应肿瘤相比,在化疗非响应的肿瘤中普遍存在RRBP1的上调。基因(敲除)或药理学(Radezolid,RRBP1抑制剂)抑制RRBP1能恢复化疗抗性的OSCC中顺铂诱导的细胞死亡。机制上,RRBP1通过调节Hippo通路中的关键蛋白YAP1来诱导化疗抗性。化疗抗性PDX模型中,RRBP1敲除可诱导顺铂介导的细胞死亡,显著降低肿瘤负荷。总体来说,本研究表明RRBP1是OSCC顺铂抗性的主要驱动因子;RRBP1通过调控Hippo通路中的YAP1介导顺铂抗性;靶向RRBP1的治疗可以逆转OSCC的顺铂抗性。
特点:基于临床样本和病理信息,以组学为切入口找新基因,同时在细胞和动物水平上进行功能验证实验。
案 例
NUPR1 promotes the proliferation and metastasis of oral squamous cell carcinoma cells by activating TFE3-dependent autophagy
FFPE蛋白质组学发现的NUPR1通过激活TFE3依赖的自噬途径促进口腔鳞状细胞癌的增殖和转移
期刊:Signal Transduction and Targeted Therapy
影响因子:38.104
单位:上海交通大学附属第九人民医院等单位
发表时间:2022年
研究思路概述:
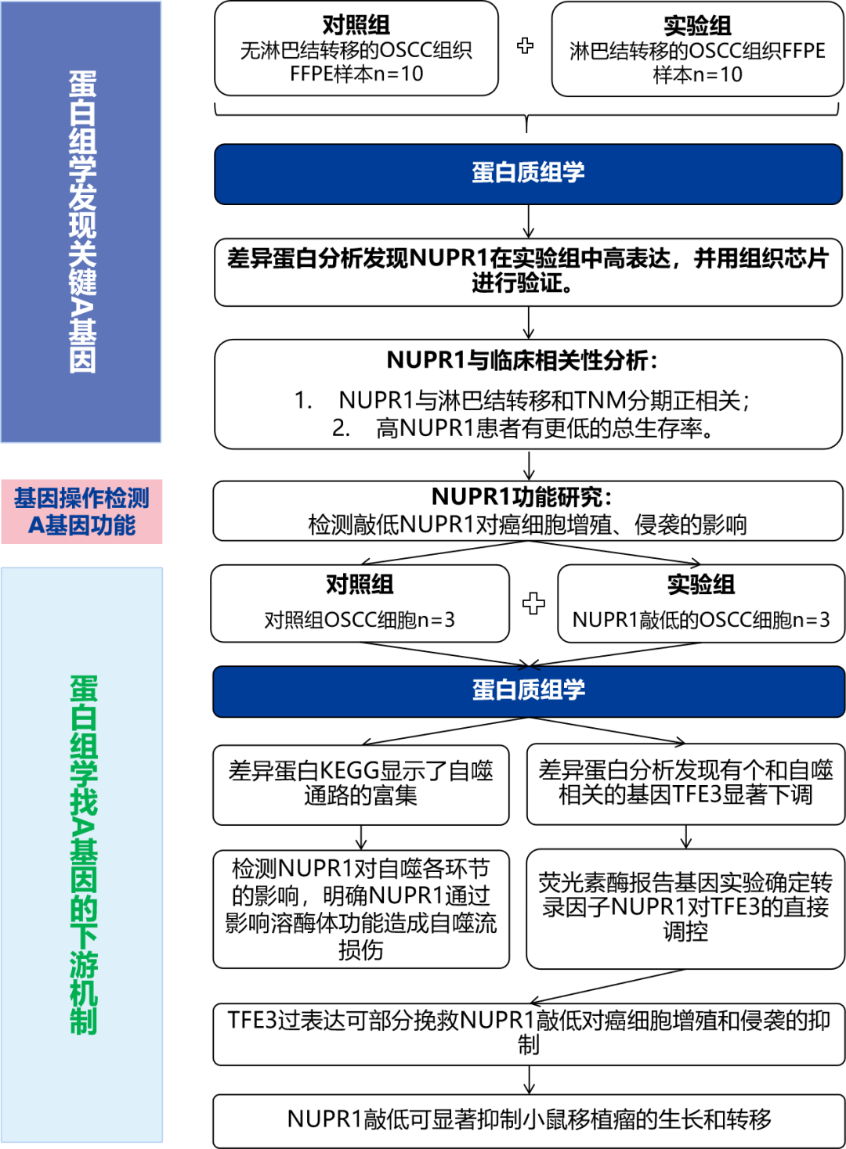
研究结果:
研究者通过FFPE蛋白质组学和分析发现NUPR1是在有淋巴结转移的口腔鳞状细胞癌患者中显著高表达的蛋白,该蛋白与OSCC转移和不良预后呈正相关。NUPR1敲低能显著OSCC细胞系的增殖和转移。后续机制实验表明NUPR1敲低诱导癌细胞自噬流损伤,且是通过影响溶酶体功能障碍而非其他关键的自噬步骤。最后,研究者进一步确认,在OSCC进展过程中,NUPR1通过增加TFE3启动子活性和激活TFE3转录来维持自噬流。总体,本研究拓宽了关于NUPR1-TFE3依赖的自噬在OSCC进展中的潜在治疗靶点的新见解。
详细文章解析请戳:IF18!以蛋白质组为突破口,国内上海交大等合作团队揭示自噬参与的促癌机制
吉凯基因凭借多年在靶标筛选及验证服务领域的技术积累,建立的标准化 、工程化 、系统化的GRP平台,为中国研究型医生提供科研服务,加快科研成果转化。其中,多组学平台包含蛋白质组学平台和高通量测序平台:
·蛋白质组学平台拥有多台timsTOF Pro、Exploris 480高精度质谱仪,专业的Spectronaut Plusar、Mascot等分析软件,提供专业的4D、DIA、TMT、PRM、磷酸化修饰组、olink蛋白质组等检测服务,强大的机器学习算法、IPA分析、蛋白基因组分析服务,系统的生物标志物、分子分型、药物靶点、基因功能研究等解决方案,真正让广大研究型医生的科研工作更省心、更省力、更高效;
·高通量测序平台分为常规测序服务和单细胞测序服务:单细胞测序拥有10x和BD两个平台,提供单细胞RNA-seq、单细胞核测序、单细胞混样RNA-seq、单细胞TCR/BCR、单细胞(RNA+ATAC)、空间转录组测序等服务;常规测序服务提供meRIP-seq(m6A/m1A/m7G/m5C 等RNA甲基化修饰测序)、acRIP-seq(ac4C RNA乙酰化修饰测序)、ATAC-seq、Ribo-seq(翻译组测序) 、mRNA/miRNA/LncRNA/circRNA-seq、全转录组测序(两文库/三文库)、外泌体miRNA/LncRNA-seq、WGS/WES、WGBS、RRBS、BSAS等服务
